


科目:高中化学 来源:不详 题型:单选题
| A.工业上煅烧石灰石制生石灰 |
| B.用明矾净水 |
| C.稀盐酸除去钢铁表面的铁锈 |
| D.工业上用铁矿石炼铁 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| ||
| A.①② | B.①③ | C.②③ | D.②④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 Cl2↑+H2↑+2NaOH。
Cl2↑+H2↑+2NaOH。 Cl2↑+ Cu d.3Cl2 + 2Fe
Cl2↑+ Cu d.3Cl2 + 2Fe 2FeCl3
2FeCl3查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
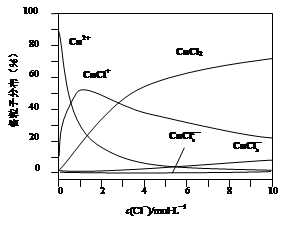
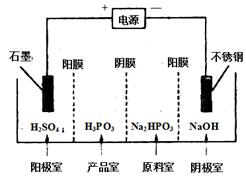
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| A.有利于空气中氧气充分反应 | B.除去空气中的水蒸气 |
| C.有利于气体混合 | D.有利于观察空气流速 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Na2O2既是氧化剂,又是还原剂 |
| B.Fe2O3在反应中得到电子 |
| C.3 mol Na2O2参加反应,转移的电子总数为12mol |
| D.Na2FeO4能消毒杀菌,因其具有强氧化性 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.1?:4 | B.1?:2 |
| C.2?:1 | D.4?:1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com