
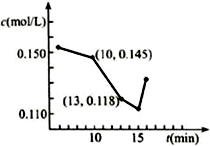
分析 (1)①15min之后钙离子浓度增大,原因是二氧化碳与碳酸钙反应生成碳酸氢钙;
②碳化反应是放热反应,温度过高,平衡逆向移动,碳酸氢镁容易分解;温度过低,反应速率较慢;
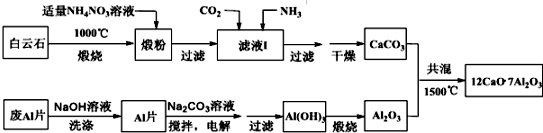
(2)白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,过滤得到碳酸钙.用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,Al片为阳极、石墨为阴极,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙.
解答 解:(1)①15min之后钙离子浓度增大,原因是二氧化碳与碳酸钙反应生成碳酸氢钙,反应的方程式为CaCO3+CO2+H2O=Ca(HCO3)2,
故答案为:CaCO3+CO2+H2O=Ca(HCO3)2;
②碳化反应是放热反应,温度过高,平衡逆向移动,碳酸氢镁容易分解,温度偏高不利于碳化反应,但温度过低,反应速率较慢,也不利于碳化反应,
故答案为:平衡逆向移动,碳酸氢镁分解;反应速率慢;
(2)白云石煅烧发生反应:CaCO3$\frac{\underline{\;高温\;}}{\;}$CaO+CO2↑,MgCO3$\frac{\underline{\;高温\;}}{\;}$MgO+CO2↑,在锻粉中加入适量的NH4NO3溶液后,镁化合物几乎不溶,由于NH4NO3溶液水解显酸性,与CaO反应生成Ca(NO3)2和NH3•H2O,故过滤后溶液中含Ca(NO3)2和NH3•H2O,将CO2和NH3通入滤液I中后发生反应:Ca(NO3)2+2NH3+CO2+H2O=CaCO3↓+2NH4NO3,过滤得到碳酸钙.用NaOH溶液可除去废Al片表面的氧化膜,电解制备Al(OH)3时,Al片为阳极、石墨为阴极,在碳酸钠溶液中搅拌电解,得到氢氧化铝,过滤加热灼烧得到氧化铝,碳酸钙和氧化铝共混加热1500°C得到七铝十二钙.
①滤液1中的离子反应是:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+,
故答案为:Ca2++2NH3+CO2+H2O=CaCO3↓+2NH4+;
②该工艺中不能用(NH4)2SO4代替NH4NO3,原因是:加入(NH4)2SO4会生成CaSO4微溶物,在过滤时会被除去,造成生成的CaCO3减少,
故答案为:加入(NH4)2SO4会生成CaSO4微溶物,在过滤时会被除去,造成生成的CaCO3减少;
③用NaOH溶液可除去Al片表面的氧化膜,反应的离子方程式为:Al2O3+2OH-=2AlO2-+H2O,
故答案为:Al2O3+2OH-=2AlO2-+H2O;
④电解制备Al(OH)3时,Al片为阳极、石墨为阴极,在碳酸钠溶液中搅拌电解,阳极得到铝离子与碳酸根离子发生双水解反应得到氢氧化铝,阳极电极反应式为:2Al-6e-+3CO32-+3H2O=2 Al(OH)3↓+3CO2↑,
故答案为:2Al-6e-+3CO32-+3H2O=2 Al(OH)3↓+3CO2↑.
点评 本题综合考查物质的制备以及分离提纯、难溶电解质的溶解平衡、化学反应速率影响因素等,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及题目给予的信息,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 熔点:CO2>KCl>SiO2 | B. | 水溶性:HCl>Cl2>CO2 | ||
| C. | 沸点:Cl2>Br2>I2 | D. | 热稳定性:HI>HBr>HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑤⑥ | B. | ①⑤⑥ | C. | ①③⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡常数减小 | B. | CaO量不变 | C. | 氧气压强不变 | D. | CaO2量减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.
乳酸亚铁([CH3CH(OH)COO]2Fe•3H2O,M=288g/mol)是一种常用的补铁剂,可通过乳酸与碳酸亚铁反应制得:CH3CH(OH)COOH+FeCO3+2H2O→[CH3CH(OH)COO]2Fe•3H2O+CO2↑.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe、Zn | B. | Al、Cu | C. | Al、Na | D. | Al、Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入催化剂,改变了反应的途径,反应的△H也随之改变 | |
| B. | 升高温度,逆反应速率加快,正反应速率减慢 | |
| C. | 升高温度,正、逆反应速率都加快,反应放出的热量不变 | |
| D. | 改变压强,平衡不发生移动,反应放出的热量不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 太阳能 | B. | 煤 | C. | 天然气 | D. | 酒精 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com