
分析 氢氧化钡为强碱,Ba(OH)2=Ba2++2OH-,稀释过程中Ba(OH)2 的物质的量不变,当溶液接近中性时要考虑水的电离,PH=-lgC(H+)计算,pH=9的Ba(OH)2 溶液中c(H+)=1×10-9mol/L,根据c(OH-)=$\frac{{K}_{W}}{C({H}^{+})}$,计算,所以将pH=9的Ba(OH)2 溶液稀释500倍后,溶液中的c(Ba2+)与c(OH-)浓度的比值约为1:10.
解答 解:Ba(OH)2=Ba2++2OH-,pH=9的Ba(OH)2 溶液中c(H+)=1×10-9mol/L,则氢氧根离子浓度为:c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-9}}$mol/L=1×10-5mol/L,钡离子的浓度为:c(Ba2+)=5×10-6mol/L,溶液稀释500倍后,氢氧离子浓度不可能小于1×10-7mol/L,只能无限接近1×10-7mol/L,而钡离子浓度为:c(SO42-)=1×10-8mol/L,
所以稀释500倍后溶液中c(Ba2+)与c(OH-)之比约为:1×10-8mol/L:1×10-7mol/L=1:10,
故答案为:1:10.
点评 本题考查了溶液pH的计算方法,题目难度中等,注意掌握溶液中氢离子、氢氧根离子浓度与溶液pH的关系,明确碱溶液稀释后不可能变成酸溶液.


科目:高中化学 来源: 题型:选择题
| A. | 澄清透明的溶液中:MnO4-、SO42-、K+、Fe3+ | |
| B. | 0.1 mol•L-1FeCl3溶液中:Mg2+、NH4+、SCN-、SO42- | |
| C. | 滴入甲基橙显黄色的溶液中:Na+、ClO-、I-、SO42- | |
| D. | 水电离产生的c(H+)=10-12 mol•L-1的溶液中:K+、Na+、NO3-、CH3COO- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
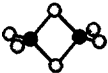 硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4
硼的最简单氢化物--乙硼烷球棍模型如图,由它制取硼氢化锂的反应为:2LiH+B2H6=2LiBH4查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )
对于已达到平衡的可逆反应:N2(g)+3H2(g)?NH3(g)+Q,Q>0,为使正逆反应速率符合如图所示,应采取的措施是( )| A. | 增大N2的浓度 | B. | 升高温度 | C. | 增大压强 | D. | 增大NH3的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 浓H2SO4和NaCl晶体 | B. | 甲酸和浓H2SO4(制CO) | ||
| C. | MnO2和浓硫酸 | D. | 浓H3PO4和NaBr晶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室中可以用生石灰与浓氨水混合的方法制取少量氨气 | |
| B. | 酸碱滴定实验中,滴定管装液前应用待装溶液润洗,锥形瓶不能用待装液润洗 | |
| C. | 在加热的情况下,烧瓶中的液体体积不要超过烧瓶容积的3/4 | |
| D. | 将KI和FeCl3溶液混合后,加入CCl4振荡静置,下层液体变紫色,说明氧化性:Fe3+>I2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com