
| 选项 | 化学反应与离子方程式 | 评价 |
| A | 将铜屑加入含Fe3+溶液中:Fe3++Cu═Fe2++Cu2- | 正确 |
| B | Na2O2与H2O反应:Na2O2+H2O═2Na ++2OH-+O2↑ | 错误,氧元素不守恒 |
| C | NaOH溶液与氧化铝反应:Al2O3+2OH-═2AlO2-+H2O | 错误,产物应该是(OH)3 |
| D | 向FeCl3溶液中滴加足量氨水:Fe3++3OH-═Fe(OH)3↓ | 正确 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.离子方程式两边总电荷不相等,违反了电荷守恒;
B.2mol过氧化钠与水反应生成1mol氧气,该反应不满足电子守恒、质量守恒;
C.氧化铝与氢氧化钠溶液反应生成偏铝酸钠和水;
D.氨水为弱碱,一水合氨按不能拆开.
解答 解:A.将铜屑加入含Fe3+溶液中,反应生成亚铁离子和铜离子,正确的离子方程式为:2Fe3++Cu═2Fe2++Cu2+,题中评价不合理,故A错误;
B.Na2O2与H2O反应生成氢氧化钠和氧气,正确的离子方程式为:2Na2O2+2H2O═4Na ++4OH-+O2↑,题中反应不满足电子守恒、质量守恒定律,该评价合理,故B正确;
C.NaOH溶液与氧化铝反应的离子方程式为:Al2O3+2OH-═2AlO2-+H2O,题中离子方程式书写正确,该评价不合理,故C错误;
D.向FeCl3溶液中滴加足量氨水,一水合氨不能拆开,正确的离子方程式为:Fe3++3NH3•H2O=Fe(OH)3↓+3NH4+,题中离子方程式错误,该评价不合理,故D错误;
故选B.
点评 本题考查化学实验方案的评价,题目难度中等,明确离子方程式的书写原则为解答关键,注意题干只要求分析“对离子方程式书写的评价”是否合理,为易错点,试题培养了学生的灵活应用能力.


 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 若Ⅰ达到平衡时,A、B、C各增加1mol,则B的转化率一定增大 | |
| B. | 若向平衡Ⅰ中再加入6mol A,4mol B.测得C的体积分数大于a,可断定x>4 | |
| C. | 若x=2,则体系Ⅱ起始物质的量应满足:3n(B)=n(A)+3 | |
| D. | 若体系Ⅱ起始物质的量满足3n(c)+4n(A)=12n(B),则可推断:x=4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
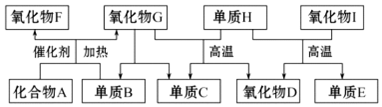
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 溶质 溶解度 溶剂 | AgNO3 | Ba(NO3)2 | AgCl | BaCl2 |
| 水中 | 170 | 9.2 | 1.5×10-4 | 33.3 |
| 液氨 | 86 | 97.2 | 0.8 | 0 |
| A. | ①③ | B. | ①④ | C. | ②③ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 实验操作 | 实验现象 | 解释与结论 |
| A | 向浓度均为0.1mol•L-1 NaCl和NaI混合溶液中滴加少量AgNO3溶液 | 出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| B | 硝酸银溶液中加足量的NaCl溶液,再加KI溶液 | 先得到白色沉淀后变为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| C | 等体积pH=3的HA和HB两种酸分别与足量的锌反应,排水法收集气体 | 相同时间内,HA收集到的氢气多 | HA是弱酸 |
| D | 用洁净的铂丝蘸待测液进行焰色反应 | 火焰呈黄色 | 溶液中含Na+,不含K+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
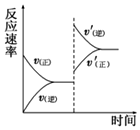 在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )
在密闭容器中,一定条件下进行反应:mA(g)+nB(g)?pC(g)+qD(g),若增大压强或升高温度,重新达到平衡,v正、v逆随时间变化过程均如图所示,下列有关叙述正确的是( )| A. | 正反应是吸热反应,m+n>p+q | B. | 逆反应是吸热反应,m+n<p+q | ||
| C. | 正反应是吸热反应,m+n<p+q | D. | 逆反应是吸热反应,m+n>p+q |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
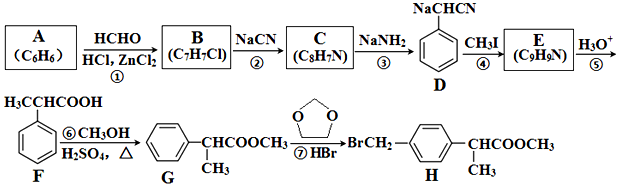
 +HCHO+HCl $\stackrel{ZnCl_{2}}{→}$
+HCHO+HCl $\stackrel{ZnCl_{2}}{→}$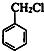 +H2O;反应⑥的化学方程式为
+H2O;反应⑥的化学方程式为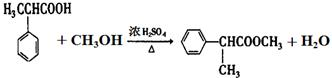 .
.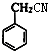 ;E的结构简式为
;E的结构简式为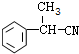 .
. .
.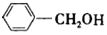 合成
合成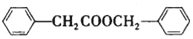 的合成
的合成 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸的电子式: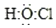 | |
| B. | 中子数为 20 的氯原子:${\;}_{17}^{37}$Cl | |
| C. | 氮原子的结构示意图: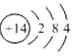 | |
| D. | Na2 S 的水解反应方程式:S2-+2H2O?H2S+2OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com