
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
 mY(g)+Z(g),测得混合气体中X的体积分数为55.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡混合气体的平均相对分子质量为( )
mY(g)+Z(g),测得混合气体中X的体积分数为55.80%,混合气体的总质量为46.00 g,混合气体的密度为0.72 g·L-1。则平衡混合气体的平均相对分子质量为( )| A.58.80 | B.46.00 | C.39.74 | D.16.13 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
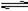 2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
2NH3(g)△H<0。在某一时间段t0~t6中反应速率与反应过程的曲线图。试回答下
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
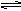 2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( )
2NH3(g),N2、H2起始分别为10mol、30mol,达平衡时H2的转化率为25%,若从NH3开始反应,在相同条件下,欲使平衡时各成分的体积分数与前者相同,则起始时NH3的物质的量及NH3的转化率为( ) | A.15mol;25% | B.20mol;50% | C.20mol;75% | D.40mol;80% |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
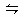 3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )
3C(g)+D(g)。现分别从两条途径建立平衡,途径Ⅰ:A、B的起始浓度均为2mol/L;途径Ⅱ:C、D的起始浓度均为6mol/L和2mol/L。下列叙述正确的是( )查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.不断将氨分离出来 | B.使用催化剂 |
| C.采用500℃左右的高温 | D.采用2×107~5×107Pa的压强 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
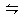 2NH3 △H<0,下列说法正确的是( )
2NH3 △H<0,下列说法正确的是( )| A.反应物和生成物的浓度 |
| B.反应物和生成物的浓度不再发生变化 |
| C.降低温度,平衡混合物中NH3的浓度减少 |
| D.增大压强,不利于氨的合成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。
H2O+NH2Cl(一氯氨),NH2Cl较HClO稳定,试分析加液氨能延长液氯杀菌时间的原因是 。查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com