
| A. | lmolC2H8N2中含有lmolN2 | |
| B. | 偏二甲肼的摩尔质量为60g | |
| C. | 偏二甲肼是比液氢更环保的燃料 | |
| D. | 偏二甲肼燃烧时能放出大量的热和气体 |
分析 A、C2H8N2是纯净物;
B、摩尔质量单位为g/mol;
C、偏二甲肼燃烧生成二氧化碳和氮气;
D、推进燃料偏二甲肼(化学式为C2H8N2),因为燃烧放出大量的热量.
解答 解:A、C2H8N2是纯净物,分子中无氮气,故A错误;
B、摩尔质量单位为g/mol,所以偏二甲肼的摩尔质量为60g/mol,故B错误;
C、偏二甲肼燃烧生成二氧化碳和氮气,所以氢燃料更环保,故C错误;
D、推进燃料偏二甲肼(化学式为C2H8N2),因为燃烧放出大量的热量,同时产生氮气和二氧化碳,所以偏二甲肼燃烧时能放出大量的热和气体,故D正确;
故选D.
点评 此题难度不大,只要认真分析题中信息并结合题中信息进行解答即可,比较容易.


科目:高中化学 来源: 题型:选择题
| A. | $\frac{vn}{22.4}$ | B. | $\frac{22.4n}{v}$ | C. | $\frac{vn}{5.6}$ | D. | $\frac{22.4n}{3v}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
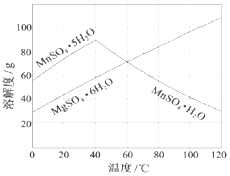 软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4
软锰矿(主要成分MnO2,杂质金属元素Fe、Al、Mg等)的水悬浊液与烟气中SO2反应可制备MnSO4•H2O,反应的化学方程式为:MnO2+SO2=MnSO4查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸钙与稀盐酸的反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 氢氧化钡与稀硫酸的反应:Ba2++SO42-═BaSO4↓ | |
| C. | 铜溶于浓硝酸:3Cu+8H++2NO3-═3Cu2++2NO↑+4H2O | |
| D. | 将小苏打加入到氢氧化钠溶液中:OH-+HCO3-═CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 蒸发 | B. | 蒸馏 | C. | 过滤 | D. | 分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 酸 | H2C2O4 | HF | H2CO3 | H3BO3 |
| 电离平衡常数Ka | Ka1=5.9×10-2 Ka2=6.4×10-5 | 未知 | Ka1=4.2×10-7 Ka2=5.6×10-11 | 5.8×10-10 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
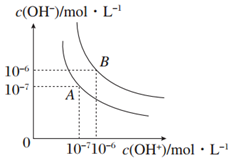 回答下列问题
回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com