
| A、NaOH、H2SO4、Ba(OH)2 |
| B、NaOH、CuSO4、H2SO4 |
| C、HCl、CuCl2、Ba(OH)2 |
| D、NaBr、H2SO4、Ba(OH)2 |


科目:高中化学 来源: 题型:
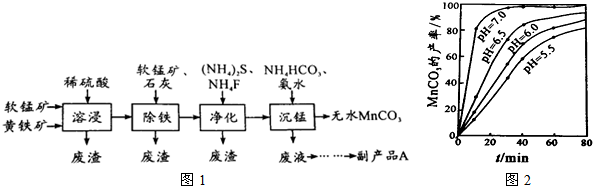
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、它耐高温抗氧化 |
| B、它比钢铁轻、硬,但质地较脆 |
| C、它没有固定熔点 |
| D、它是一种新型无机非金属材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
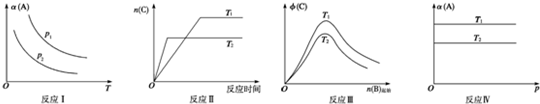
| A、反应Ⅰ:若p1<p2,则a+b<c |
| B、反应Ⅱ:此反应的△H<0,且T1<T2 |
| C、反应Ⅲ:△H>0且T2>T1或△H<0且T2<T1 |
| D、反应Ⅳ:T1<T2,则该反应不易自发进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H+和CO32- |
| B、HCO3-和HSO4- |
| C、Na+、HCO3-和H+ |
| D、HCO3-和H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向H2S水溶液中加入NaOH固体有利于S2-增多 |
| B、鼓入过量空气有利于SO2转化为SO3 |
| C、H2、I2、HI平衡混合气加压后颜色变深 |
| D、合成 NH3反应,为提高 NH3的产率,理论上应采取相对较低温度的措施 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、1 mol O的质量是16 g/mol |
| B、Na的摩尔质量是23 g/mol |
| C、CO2的摩尔质量是44 g |
| D、氢的摩尔质量是2 g/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com