
【题目】丙烯酸可与水反应生成乳酸,化学方程式如下,下列说法正确的是

A. 该反应为加成反应,没有副产物生成
B. 可用Br2/CCl4溶液鉴别丙烯酸和乳酸
C. 丙烯酸与乳酸都属于有机酸,两者不发生反应
D. 1mol乳酸分别与足量Na、NaOH、NaHCO3反应,消耗三者物质的量之比为2:2:1
 名校名师培优作业本加核心试卷系列答案
名校名师培优作业本加核心试卷系列答案 全程金卷系列答案
全程金卷系列答案科目:高中化学 来源: 题型:
【题目】微生物电池是指在微生物的作用下将化学能转化为电能的装置,下图是利用一种微生物将废水中的尿素[CO(NH2)2]转化为对环境无害物质的装置。下列叙述错误的是

A. M电极有CO2和N2生成
B. H+透过质子交换膜由左向右移动
C. 微生物促进了反应中电子的转移
D. N电极反应式为O2 + 2H2O + 4e﹣= 4OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现代煤化工产生的H2S是一种重要的工业资源。请回答:
(1)用过量的NaOH吸收H2S,请写出该反应的离子方程式:____________。硫化钠又称臭碱,其溶液盛装在带橡胶塞的试剂瓶中,请用离子方程式解释其溶液呈碱性的原因为:_______。己知:25℃时,H2S的Ka1=1×10-7,Ka2=1×10-12,计算此温度时1mol/LNa2S溶液的pH=____。(结果取整数)
(2)用电解法处理Na2S溶液是处理硫化氢废气的一个重要环节。实验装置如图:

已知阳极的反应为xS2--2(x-1)e-=Sx2-,则阴极的电极反应式是_________,当反应转移nmole-时,产生标准状况下的气休体积为__________________。
(3)H2S是煤化工原料气脱硫过程的重要中间体。反应原理为:
①COS(g)+H2(g)![]() H2S(g)+CO(g) △H=+7kJ/mol
H2S(g)+CO(g) △H=+7kJ/mol
②CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-42kJ/mol
CO2(g)+H2(g) △H=-42kJ/mol
已知断裂1mol气态分子中的化学键所需能量如下表所示。
分子 | COS | H2 | H2O | CO | H2S | CO2 |
能量/kJ/mol | 1323 | 436 | 926 | X | 678 | 1606 |
计算表中x=____________。
(4)向2L容积不变的密闭容器中充入2molCOS(g),2molH2(g)和2molH2O(g),进行(3)中所述两个反应,其他条件不变,随着温度升高,CO的平衡体积分数增大,解释其原因为_____________。平衡体系中COS的物质的量为1.6mol时,CO的体积分数为5%,则H2O的平衡转化率为______,反应②的平衡常数为______(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如下图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是
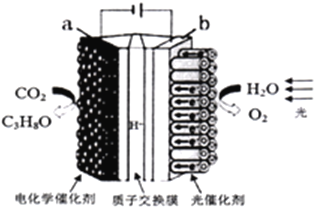
A. 该装置将化学能转化为光能和电能
B. a电极的反应为:3CO2+16H+-18e-=C3H8O+4H2O
C. 该装置工作时,H+从b极区向a极区迁移
D. 每生成1molO2有44gCO2被还原
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴苯是一种常用的化工原料。实验室制备溴苯的实验步骤如下:

步骤1:在a中加入20mL苯和少量铁屑,再将b中4.0 mL液溴慢慢加入到a中充分反应.将b 中的液溴慢慢加入到a中,而不能快速加入的原因是_______________。继续滴加液溴至完全加入。装置d的作用是___________________。
步骤2:向a中加入15mL水,然后_____________(填操作名称)除去未反应的铁屑。
步骤3:再依次用10mL水、8mL10%的Na0H溶液、10mL水洗涤,分液得粗溴苯。Na0H溶液洗涤的作用是________________。
步骤4:向分出的粗溴苯中加入少量的无水氯化钙.静置、过滤即得粗产品。加入氯化钙的目的是_______。
已知溴、苯、溴苯的有关物理性质如下表:
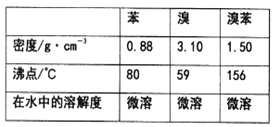
(1)实验装置中,仪器c的名称为______________,作用是冷凝回流.回流的主要物质有_______________(填化学式)。
(2)步骤4得到的粗产品中还含有杂质苯,则要进一步提纯粗产品,还必须进行的实验操作名称是_______________。
(3)在该实验中,a的容积最适合的是_________(填入正确选项前的字母)。
A.500mL B. 250 mL C.10O mL D.50 mL
(4)若步骤4的粗产品经进一步精制得到5.7mL的溴苯,则该实验中溴苯的产率是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中,对于可逆反应A(g)+B(g)![]() 2C(g),可以判断达到化学平衡状态的是
2C(g),可以判断达到化学平衡状态的是
A. 体系压强不变 B. A的浓度不变
C. 单位时间消耗mol A,同时生成2 nmol C D. 容器内气体密度不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】古代《药性论》中有关铅丹(Pb3O4)的描述是治惊悸狂走,呕逆,消渴”,铅丹(Pb3O4)也可作为防锈用涂料,呈红褐色,又名红丹。
(1)将PbO高温焙烧可制得铅丹,请写出反应的化学方程式 __________。
(2)下面关于铅丹的说法正确的是_________(填字母序号)
A.由于其中含铅,易造成铅中毒,故应慎用
B.用它配成的漆,附着力很强,在大气中有相当的稳定性
C.红丹抗腐蚀性强,耐高温,耐酸、碱
D.红丹不溶于水
(3)请举例说明铁制品防锈的其他两种方法_____________。
(4)铅丹具有氧化性,能与浓盐酸反应,请写出反应的化学方程式_____,简要回答检验上述反应生成的氧化产物的实验方法________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作或方法中,正确的是( )
A. 海水淡化 ------蒸馏 B. 将碘单质从沙子提取出来--------过滤
C. 盐水中获得食盐--------萃取分液 D. 稀释浓硫酸时将水慢慢加入浓硫酸中
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com