
关于下列各实验装置的叙述中,不正确的是
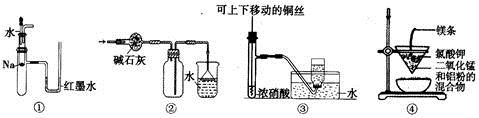
A. 装置①可用于验证Na与H2O反应是否放热
B. 装置②可用于干燥、收集NH3,并吸收多余的NH3
C. 装置③可用于制备并收集少量NO
D. 装置④可制得金属锰
科目:高中化学 来源:2016-2017学年内蒙古高二上期中化学卷(解析版) 题型:选择题
在一密闭容器中进行反应2SO2 + O2 = 2SO3,已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1mol/L、0.2mol/L,当反应达平衡时,可能存在的数据是( )
A.SO2为 0.4mol/L,O2为0.2mol/L B.SO2为0.25mol/L
C.SO2、SO3均为0.15mol/L D.SO3为0.4mol/L

查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期中化学卷(解析版) 题型:选择题
下列说法正确的是
A.常温下,pH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol·L-1
B.温度相同时,在弱酸溶液和强碱稀溶液中,水的离子积常数Kw相同
C.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低
D.中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:填空题
A、B、C、D、E、F是原子序数依次增大的短周期主族元素,A、E在元素周期表中的相对位置如图,A与氧元素能形成两种无色气体,C是地壳中含量最多的元素,D是地壳中含量最多的金属元素。
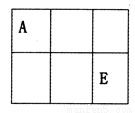
(1)C在元素周期表中的位置为________,其离子的结构示意图为________________。
(2)AE2的分子式为______________。
(3)C、E、F的单质沸点最低的是__________(填化学式)。
(4)C、D、E、F的离子半径由大到小的顺序是___________(填离子符号)。
(5)实验室制取F2气体的离子方程式为____________。
(6)在微电子工业中,B的最简单气态氢化物的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为_____________________。
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:选择题
下列表示对应化学反应的离子方程式正确的是
A.用KIO3氧化酸性溶液中的K I:5I-+IO3-+3H2O=3I2+6OH-
I:5I-+IO3-+3H2O=3I2+6OH-
B.将过量SO2通入冷氨水中:SO2+NH3+H2O=HSO3-+NH4+
C.向NH4HCO3溶液中加过量的NaOH溶液并加热:NH4++OH- NH3↑+H2O
NH3↑+H2O
D.用稀硝酸洗涤试管内壁的银镜:Ag+2H++NO3-=Ag++NO↑+H2O
查看答案和解析>>
科目:高中化学 来源:2017届山东省泰安市高三上学期期中化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值,下列说法正确的是
A.18 g H2O含有10NA个质子
B.7.8 g  Na2O2中含有的阴离子数是0.2NA
Na2O2中含有的阴离子数是0.2NA
C.标准状况下,22.4 L氨水含有NA个NH3分子
D.56 g铁片投入足量浓H2SO4中生成NA个SO2分子
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省铁岭市协作体高三第三次联考化学试卷(解析版) 题型:选择题
某化学研究小组探究外界条件对化学反应mA(g)+nB(g) pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
pC(g)的速率和平衡的影响图象如下,下列判断正确的是( )
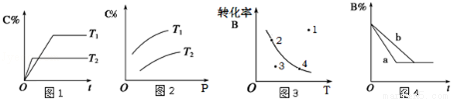
A.由图1可知,T1<T2,该反应正反应为吸热反应
B.由图2可知,该反应m+n<p
C.图3中,表示反应速率v正>v逆的是点3
D.图4中,若m+n=p,则a曲线一定使用了催化剂
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省高三第三次月考化学试卷(解析版) 题型:简答题
“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2。CO和H2可作为能源和化工原料,应用十分广泛。生产煤炭气的反应之一是:
C(s)+H2O(g) CO(g)+H2(g)ΔH=+131.4kJ/mol
CO(g)+H2(g)ΔH=+131.4kJ/mol
(1)在容积为3 L的密闭容器中发生上述反应,5 min后容器内气体的密 度增
度增 大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
大了0.12 g/L,用H2O表示0 ~ 5 min的平均反应速率为______________________。
(2)关于上述反应在化学平衡状态时的描述正确的是 。
A.CO的含量保持不变
B.v正(H2O)= v正(H2)
C.容器中混合气体的平均相对分子质量保持不变
(3)若上述反应在t0时刻达到平衡(如图),在t1时刻改变某一条件,请在右图中继续画出t1时刻之后正反应速率随时间的变化:

①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示)。
(4)在一定条件下用CO和H2可以制得甲醇,CH3OH和CO的燃烧热为别725.8 kJ/mol ,283.0 kJ/mol,水的摩尔蒸发焓为44.0 kJ/mol,写出甲醇不完全燃烧生成一氧化碳和气态水的热化学方程式: 。
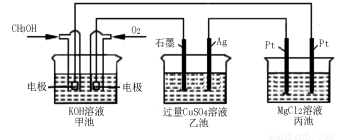
(5)如下图所示,以甲醇燃料电池作为电源实现下列电解过程。乙池中发生反应的离子方程式为 。当 甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
甲池中增重16 g时,丙池中理论上产生沉淀质量的最大值为 g。
查看答案和解析>>
科目:高中化学 来源:2017届福建省高三上期中化学试卷(解析版) 题型:实验题
氮的氧化物(NOx)是大气污染物之一。工业生产硝酸的尾气中含有氮氧化物NOx(NO和NO2的混合物,假设不含N2O4),常见处理法有:
(1)可用氨催化吸收法处理NOx,反应原理如下:4xNH3+6NOx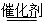 (2x+3)N2+6xH2O
(2x+3)N2+6xH2O
某化学兴趣小组模拟该处理过程的实验装置如下:

①装置A中发生反应的化学方程式为________________________________。
②装置D中碱石灰的作用是____________________。
(2)用Na2CO3溶液吸收法处理NOx。已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2 (Ⅰ)
2NO2+Na2CO3===NaNO2+NaNO3+CO2 (Ⅱ)
①当NOx被Na2CO3溶液完全吸收时,x的值不可能是________(填字母)。
A.1.9 B.1.7 C.1.5 D.1.3
②用足量的Na2CO3溶液完全吸收NOx,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则NOx中的x值为________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com