
| A. | 3个 | B. | 4 个 | C. | 5个 | D. | 6个 |
分析 ①量筒的感量为0.1mL,液体的体积与量筒的规格要接近;
②氯水中含HClO,具有漂白性;
③蒸发皿可直接加热;
④Al与NaOH溶液反应,而Fe不能;
⑤醋酸与水垢反应;
⑥氧化铝的熔点高,包裹在Al的外面;
⑦硝酸钾、氯化钠的溶解度受温度影响不同.
解答 解:①量筒的感量为0.1mL,液体的体积与量筒的规格要接近,则用10mL量筒准确量取稀硫酸溶液8.0mL,故正确;
②氯水中含HClO,具有漂白性,不能利用pH试纸测pH,选pH计,故错误;
③蒸发皿可直接加热,而圆底烧瓶、锥形瓶加热时都应垫在石棉网上,故错误;
④Al与NaOH溶液反应,而Fe不能,则加入过量的氢氧化钠溶液,完全反应后过滤可除杂,故正确;
⑤醋酸与水垢反应,则用食醋除去水壶中的水垢,故正确;
⑥氧化铝的熔点高,包裹在Al的外面,则铝箔在酒精灯上加热,熔化后的液态铝不会滴落,故正确;
⑦硝酸钾、氯化钠的溶解度受温度影响不同,氯化钠中混有少量的硝酸钾,氯化钠是大量的,制得的饱和溶液中硝酸钾量较少,不能采取降温结晶的方法,故错误;
故选B.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验评价性分析,题目难度不大.


 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案科目:高中化学 来源: 题型:多选题
| A. | 光束通过该液体时形成光亮的“通路” | |
| B. | 插入石墨电极通直流电后,有一极附近液体颜色加深 | |
| C. | 向该液体中加入硝酸银溶液,无沉淀产生 | |
| D. | 将该液体加热、蒸干、灼烧后,有黑色固体生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ②④ | C. | ①② | D. | ③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH4+ NO3- CO32- Na+ | B. | Na+ Ba2+ Mg2+ HCO3- | ||
| C. | NO3- Ca2+ K+ Cl- | D. | NO3- K+[Al(OH)4]- H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
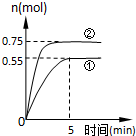 碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:
碳循环的途径之一是:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)+49.0kJ,在容积为2L的密闭容器中充入1mol CO2和3mol H2,在两种不同的实验条件下进行反应,测得CH3OH(g)的物质的量随时间变化情况如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
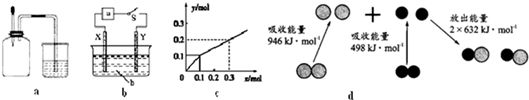
| A. | 如图a所示,集气瓶内充满Cl2和CH4的混合气体或NO2和O2的混合气体,置于光亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,并可能充满集气瓶 | |
| B. | 如图b所示,X为铁棒,Y为铜棒,a为直流电源,当S闭合后,当b为NaOH溶液,X极附近产生白色沉淀时,电子从X极流入a | |
| C. | Pt为电极,电解含0.10 mol M+和0.1 mol N3+(M+、N3+均为金属阳离子)的溶液,阴极析出金属单质或气体的总物质的量(y)与导线中通过电子的物质的量(x)的关系如图c,离子氧化能力M+>N3+>H+ | |
| D. | 图d为N2(g)和O2(g)生成NO(g)过程中的能量变化,则N≡N的键能为946kJ/mol,热化学方程式为:N2(g)+O2(g)=2NO(g)△H=-180 kJ/mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com