
下列试剂中,不能贮存在玻璃瓶中的是
A.浓硫酸 B.氢氟酸 C.浓氢氧化钠溶液 D.硝酸银溶液
 ABC考王全优卷系列答案
ABC考王全优卷系列答案科目:高中化学 来源: 题型:
下列反应中生成H2的速率最快的是 ( )
| 金属 | 酸溶液 | 温度 | |
| A | Zn | 0.5mol·L-1 H2SO4 | 20℃ |
| B | Fe | 1 mol·L-1HCl | 20℃ |
| C | Al | 2 mol·L-1HCl | 30℃ |
| D | Mg | 2 mol·L-1H2SO4 | 30℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:
在可逆反应2SO2+O2 2SO3中,充入一定量的18O2,足够长的时间后,18O原子
2SO3中,充入一定量的18O2,足够长的时间后,18O原子
A.只存在于O2中 B.只存在于O2和SO3中
C. 只存在于O2和SO2中 D. 存在于O2、SO2和SO3中
查看答案和解析>>
科目:高中化学 来源: 题型:
某同学设计了如下实验流程:在一个小烧杯里,加入20g Ba(OH)2·8H2O晶体和10gNH4Cl晶体,然后将小烧杯放在事先已滴有3滴~4滴水的玻璃片上,并立即用玻璃棒迅速搅拌。实验流程示意图如下,回答下列问题:

⑴ 实验中玻璃棒的作用是 。
⑵ 浸有稀硫酸的棉花的作用是 。
⑶ 通过 现象,说明该反应为 (填“吸热”或“放热”)反应,这是由于反应物的总能量 (填“小于”、 “大于” 或“等于”)生成物的总能量。
查看答案和解析>>
科目:高中化学 来源: 题型:
在容积为1.00 L的容器中,通入一定量的N2O4,发生反应N2O4(g)2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH________0(填“大于”或“小于”);100 ℃时,体系中各物质浓度随时间变化如图所示。在0~60 s时段,反应速率v(N2O4)为________mol·L-1·s-1;反应的平衡常数K1为________。
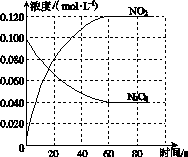
(2)100 ℃时达平衡后,改变反应温度为T,c(N2O4)以0.002 0 mol·L-1·s-1的平均速率降低,经10 s又达到平衡。
①T________100 ℃(填“大于”或“小于”),判断理由是____________________________。
②列式计算温度T时反应的平衡常数K2:_______________________________________
________________________________________________________________________。
(3)温度T时反应达平衡后,将反应容器的容积减少一半,平衡向________(填“正反应”或“逆反应”)方向移动,判断理由是__________________________________________________
________________________________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com