
����Ŀ��A��B��C��X��Y��Z��Ԫ�����ڱ��е�ǰ20��Ԫ�أ���ԭ����������������֪���ǵIJ��ֻ�������������£�
A�� �⻯�� | B�� �⻯�� | C�� �⻯�� | X�� ������ | Y���⻯�� ���ӹ��� | Zԭ�� |
��������� ���л��� | ˮ��Һ �ʼ��� | ˮ��Һ ������ | ���� ������ | �������� | �۵����Ų�Ϊ4s2 |
�ش��������⣺
(1)д����ӦԪ�ص�������A__________��B__________��C__________��X__________��Y__________��Z__________
(2)X��Y��Z����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳���ǣ���Ԫ�ط��ź���>����ʾ����__________
(3)д��B���⻯����C���⻯�ﷴӦ��������ĵ���ʽ��__________��
(4)��֪C�ĵ�������ˮ�в���һ�ֳ����������Ե��ʣ���д���÷�Ӧ�Ļ�ѧ����ʽ��
__________��
(5)�ԱȽ�A��Y������������۵�ĸߵͣ��þ������ʻ�ѧʽ��">"��"<"��"="��ʾ����__________��˵������__________��
���𰸡� ̼ �� �� �� �� �� Ca �� Al�� Si 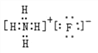 2F2 + 2H2O = 4HF + O2 CO2�� SiO2 CO2Ϊ���Ӿ��壬�ɷ��Ӽ���������ϣ���SiO2Ϊԭ�Ӿ��壬�ɹ��ۼ���ϡ����ۼ�ǿ�ȴ��ڷ��Ӽ�����������SiO2�۵��CO2���۵�ߡ�
2F2 + 2H2O = 4HF + O2 CO2�� SiO2 CO2Ϊ���Ӿ��壬�ɷ��Ӽ���������ϣ���SiO2Ϊԭ�Ӿ��壬�ɹ��ۼ���ϡ����ۼ�ǿ�ȴ��ڷ��Ӽ�����������SiO2�۵��CO2���۵�ߡ�
��������A�Ǻ�������ߵ��л��ӦΪCH4����AΪCԪ�أ�B������⻯��ˮ��Һ�ʼ��ԣ�ӦΪNH3����BΪNԪ�أ�C���⻯��ˮ��Һ�����ԣ�����ΪF��S��Cl�����ʵĶ�Ӧ���⻯�X��������Ϊ���������Ϊ������������XΪAlԪ��������ԭ������������������CΪFԪ����Y������⻯����ӹ������������壬ӦΪSiԪ����Z�ļ۵����Ų�Ϊ4s2��ӦΪCaԪ�ء�
(1)�������������� AΪCԪ�أ� BΪNԪ�أ�CΪFԪ�أ� XΪAlԪ�أ�YΪSiԪ�أ�ZΪCaԪ�أ��ʴ�Ϊ��̼�� ���� ���� ���� �� �� �ƣ�
(2)һ����ԣ����Ӳ���Խ�࣬ԭ�Ӱ뾶Խ���Ӳ�����ͬ��ԭ������Խ��ԭ�Ӱ뾶ԽС��X��Y��Z����Ԫ��ԭ�Ӱ뾶�ɴ�С��˳����Ca �� Al�� Si���ʴ�Ϊ��Ca �� Al�� Si��
(3)B���⻯����C���⻯�ﷴӦ��������Ϊ����泥��������ӻ��������ʽΪ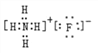 ���ʴ�Ϊ��
���ʴ�Ϊ��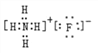 ��
��
(4)������ˮ��Ӧ������������������Ӧ�Ļ�ѧ����ʽΪ2F2 + 2H2O = 4HF + O2���ʴ�Ϊ��2F2 + 2H2O = 4HF + O2��
(5)CO2Ϊ���Ӿ��壬�ɷ��Ӽ���������ϣ���SiO2Ϊԭ�Ӿ��壬�ɹ��ۼ���ϡ����ۼ�ǿ�ȴ��ڷ��Ӽ�����������SiO2�۵��CO2���۵�ߣ��ʴ�Ϊ��CO2�� SiO2��CO2Ϊ���Ӿ��壬�ɷ��Ӽ���������ϣ���SiO2Ϊԭ�Ӿ��壬�ɹ��ۼ���ϡ����ۼ�ǿ�ȴ��ڷ��Ӽ�����������SiO2�۵��CO2���۵����


 ͬ��������ϰϵ�д�
ͬ��������ϰϵ�д� �ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
�ο�ͨ�γ̱�˼ά����������ѵ��ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ϩ��һ����Ҫ�Ļ�������ԭ�ϣ�����Ϊԭ�ϻ����Ժϳɺܶ�Ļ�����Ʒ����������ת����

��1������ϩ�Ľṹ��ʽΪ ��
��2��д�����·�Ӧ�Ļ�ѧ����ʽ�ͷ�Ӧ���ͣ�
�� ����Ӧ������
�� ����Ӧ������
��3��ʵ��������ͼװ���Ʊ������������Թ������Ƭ�������� ������a�������ǵ����� ���Թ�b�ڱ���Na2CO3��Һ������һ�����dz�ȥ���������л��е�������Ҵ�����һ������ ��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪ�������ȡ����Ӧ��ʵ��װ��ͼ������AΪ�ɾ�֧�Թ��Ƴɵķ�Ӧ�����������¶˿���һ��С�ף�����ʯ���ޣ��ټ���������м�ۡ�
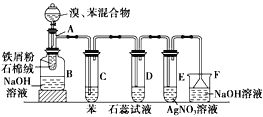
��д���пհף�
(1)��Ӧ����A����μ�����ͱ��Ļ��Һ���������ھͷ�����Ӧ��д��A����������Ӧ�Ļ�ѧ����ʽ���л���д�ṹ��ʽ����_____________________��
(2)�Թ�C�б���������___________________________����Ӧ��ʼ�۲�D��E���Թܣ�����������ΪD��_________________��E��________________��
(3)��Ӧ2~3min����B�е�NaOH��Һ��ɹ۲쵽��������___________________��
(4)����������װ���У����з��������õ�װ����______________������ĸ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��NO2��SO2�ܷ�����Ӧ��NO2+SO2![]() SO3+NO��ij�о�С��Դ˽������ʵ��̽����
SO3+NO��ij�о�С��Դ˽������ʵ��̽����
(1)���᳧��������ŷ�NO2��ɵĻ���������_______________��
(2)Ϊ�˼���SO2���ŷţ�����SO2������ͨ��ϴ�Ӽ�X��������պ��������պ����Һ�м���ϡ���ᣬ�ȿ��Ի���SO2��ͬʱ�ֿɵõ����ʡ�����ϴ�Ӽ�X������______(ѡ�����)��
a��Ca(OH)2 b��K2CO3 c��Na2SO3 d��NH3��H2O
(3)ʵ���У�β�������ü���Һ���ա�NaOH��Һ����NO2ʱ�������ķ�ӦΪ��2NO2+2OH-=NO2-+NO3-+H2O����Ӧ���γɵĻ�ѧ����___________(�ѧ��������)����NaOH��Һ��������SO2�����ӷ���ʽΪ____________��
(4)��֪��2NO(g)+O2(g)![]() 2NO2(g) ��H=-113.0kJ��mol-1
2NO2(g) ��H=-113.0kJ��mol-1
2SO2(g)+O2(g)![]() 2SO3(g) ��H=-196.6kJ��mol-1
2SO3(g) ��H=-196.6kJ��mol-1
��NO2(g)+SO2(g)![]() SO3(g)+NO(g) ��H=_______��
SO3(g)+NO(g) ��H=_______��
(5)�ڹ̶�������ܱ������У�ʹ��ij�ִ������ı�ԭ�������[n0(NO2)��n0(SO2)]���ж���ʵ��(����ʵ����¶ȿ�����ͬ��Ҳ���ܲ�ͬ)���ⶨNO2��ƽ��ת������[a(NO2)]������ʵ������ͼ��ʾ��
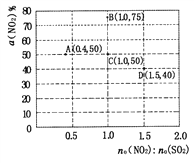
�����Ҫ��ͼ��C���ƽ��״̬�ı�ΪB���ƽ��״̬��Ӧ��ȡ�Ĵ�ʩ��_________��
����A���Ӧʵ���У�SO2(g)����ʼŨ��Ϊc0 mol��L-1������t min�ﵽƽ��״̬����ʱ�λ�ѧ��Ӧ����v(NO2)= ____mol��L��min-1��
��ͼ��C��D�����Ӧ��ʵ���¶ȷֱ�ΪTc��Td��ͨ�������жϣ�Tc_____ Td (�>������=����<��)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʶ�Ϊ1mol��NH4HCO3ϡ��Һ��Ba(OH)2ϡ��Һ��ϣ���������ʾ�÷�Ӧ���ӷ���ʽ����
A. CO32-+Ba2+��BaCO3��
B. HCO3-+OH-��H2O+CO32-
C. Ba2++2OH��+NH4++HCO3-��BaCO3��+NH3H2O+H2O
D. Ba2++OH��+NH4++HCO3-��BaCO3��+NH3H2O+H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й���Ԫ�ص�������ȷ����( )
A. ����Ԫ����ǽ���Ԫ�����γɹ��ۻ�����
B. ֻ����ԭ���У����������������������
C. Ŀǰʹ�õ�Ԫ�����ڱ��У�������ں���36��Ԫ��
D. �ǽ���Ԫ���γɵĹ��ۻ������У�ԭ�ӵ�����������ֻ����2��8
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵������ȷ����
A. ������ϩ������ʳ�ﱣ��Ĥ B. ���ȷ�Ӧ�����ں��Ӹֹ�
C. Һ�ȿ��Ա����ڸ�ƿ�� D. �����¿������۳�����Ũ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��þ����������ȼ�ϵ�صĹ���ԭ����ͼ��ʾ,�õ�ط�ӦΪMg+ClO-+H2O��Mg(OH)2+Cl-�����й�˵����ȷ����

A. ��ع���ʱ,c��Һ�е�������MgCl2
B. ��ع���ʱ,����a������pH����������
C. ������Ӧʽ:ClO--2e-+H2O��Cl-+2OH-
D. b�缫������ԭ��Ӧ,ÿת��0.1 mol����,����������0.1 mol Cl-
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��100��ʱ�����ݻ�Ϊ2L���ܱ������г���һ������X�����Y���壬�������·�Ӧ��X(g)��2Y(g) ![]() Z(g)��Ӧ�����вⶨ�IJ������ݼ��±���
Z(g)��Ӧ�����вⶨ�IJ������ݼ��±���
��Ӧʱ��/min | n(X)/mol | n(Y)/ mol |
0 | 2.00 | 2.40 |
10 | 1.00 | |
30 | 0.40 |
����˵����ȷ����
A. ǰ10 min�ڷ�Ӧ��ƽ������Ϊv(Z)��0.10 mol��L��1��min��1
B. �¶�Ϊ200��ʱ��������Ӧƽ�ⳣ��Ϊ20��������ӦΪ���ȷ�Ӧ
C. ���ܱ���������ɱ䣬�����������䣬�ڴﵽƽ�����С�������Ϊԭ��һ�룬��c(X)��1mol/L
D. ���������������䣬���������ٳ���1.00 mol X�����1.20 mol Y���壬����ƽ���Xת��������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com