
右图是用0.1000 mol·L-1 NaOH溶液滴定20.00 mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是

A.水电离出的氢离子浓度:a>b
B.盐酸的物质的量浓度为0.0100 mol·L-1
C.指示剂变色时,说明盐酸与NaOH恰好完全反应
D.当滴加NaOH溶液10.00 mL时,该混合液的pH=1+lg3
D
【解析】
试题分析:A、a点时加入NaOH较少,盐酸过量,溶液中c(H+)较大,c(H+)越大,水的电离程度越小,因此有水电离出的氢离子浓度:a<b,故A错误;B、加入NaOH溶液20.00mL时,酸碱恰好中和,由c(酸)×V(酸)=c(碱)×V(碱)可知,盐酸的物质的量浓度为0.1000 mol•L-1,故B错误;C、指示剂为酚酞,溶液变色范围为8.2~10,溶液呈碱性,NaOH过量,并不是恰好完全反应,故C错误;D、当滴加NaOH溶液10.00 mL时,盐酸过量,则此时溶液中c(H+)=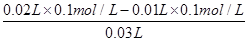 =
=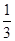 ×10-1mol/L,则pH=1+lg3,故D正确,答案选D。
×10-1mol/L,则pH=1+lg3,故D正确,答案选D。
考点:考查酸碱中和反应的有关判断和计算以及图像识别


 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
实验室常用MnO2与浓盐酸反应制备Cl2(反应装置如右图所示)。
 (1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
(1)制备实验开始时,先检查装置气密性,接下来的操作依次是 (填序号)。
A.往烧瓶中加入MnO2粉末
B.加热
C.往烧瓶中加入浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出的下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn反应,测量生成的H2体积。
继而进行下列判断和实验:
①判定甲方案不可行,理由是 。
②进行乙方案实验:准确量取残余清液稀释一定的倍数后作为试样。
a.量取试样20.00mL,用0.1000 mol·L—1NaOH标准溶液滴定,消耗22.00mL,该次滴定测的试样中盐酸浓度为 mol·L—1;
b.平行滴定后获得实验结果。
 ③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
③判断丙方案的实验结果 (填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3)=2.8×![]() 、Ksp(MnCO3)=2.3×
、Ksp(MnCO3)=2.3×![]() ]
]
④进行丁方案实验:装置如右图所示(夹持器具已略去)。
(i)使Y形管中的残余清液与锌粒反应的正确操作是将 转移到 中。
(ii)反应完毕,每间隔1分钟读取气体体积、气体体积逐渐减小,直至不变。气体体积逐次减小的原因
是 (排除仪器和实验操作的影响因素)。
查看答案和解析>>
科目:高中化学 来源:2011届四川省内江六中高考前热身试题(理综)化学部分 题型:实验题
(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一 ]探究浓硫酸的氧化性
]探究浓硫酸的氧化性 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略) (1)该装置设计上存在明显缺陷,其缺陷是 __________
(1)该装置设计上存在明显缺陷,其缺陷是 __________ _______________________ ___。
_______________________ ___。 (2)装置甲中反应的化学方程式是___________ ___。
(2)装置甲中反应的化学方程式是___________ ___。 (3)装置乙中的试剂是_____________________________________________________。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质 (4)请你帮助张明同学完成如下实验方案:
(4)请你帮助张明同学完成如下实验方案:
| 实验操作 | 预期现象和结论 |
 | |
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:

 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑) ①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化; ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定; ③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。 请回答:
请回答: (5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________ ___。 (7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
(7)原H2O2溶液中溶质的质量分数是__________ _____ ____。
查看答案和解析>>
科目:高中化学 来源:2010-2011学年四川省高考前热身试题(理综)化学部分 题型:实验题
(18分)
张明同学对硫酸及其盐的某些性质中进行了如下实验探究。
[实验一]探究浓硫酸的氧化性
 将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
将实验室常用的药品放入如右图所示的实验装置后,加热装置甲。(夹持和加热装置省略)
(1)该装置设计上存在明显缺陷,其缺陷是 _________________________________ ___。
 (2)装置甲中反应的化学方程式是___________
___。
(2)装置甲中反应的化学方程式是___________
___。
(3)装置乙中的试剂是_____________________________________________________。
[实验二 ]探究某硫酸亚铁盐固体是否变质
]探究某硫酸亚铁盐固体是否变质
(4)请你帮助张明同学完成如下实验方案:
|
实验操作 |
预期现象和结论 |
|
|
|
[实验三]用KHSO4制取H2O2并测其质量分数[来源:Z|xx|k.Com]
 查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
查阅资料得知:工业上用电解KHSO4饱和溶液制取H2O2,示意图如下:
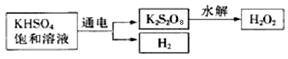
 张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
张明用此法制取一定浓度的H2O2,并进行下列实验测定H2O2的质量分数:(离子方程式:2MnO4―+5H2O2+6H+=2Mn2++8H2O+5O2↑)
①取5.00 mL H2O2溶液(密度为1.00 g/mL)置于锥形瓶中加水稀释,再加稀硫酸酸化;
 ②用0.1000 mol/L KMnO4溶液滴定;
②用0.1000 mol/L KMnO4溶液滴定;
③用同样方法滴定,三次消耗KMnO4溶液的体积分别为20.00 mL、19.98 mL、20.02 mL。
 请回答:
请回答:
(5)电解饱和KHSO4溶液时,阳极的电极反应式为____________________________。
 (6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________
___。
(6)操作②中,滴入第一滴KMnO4溶液,溶液紫红色消失很慢,随着滴定过程中Mn2+的增多,溶液紫红色消失速率加快。Mn2+的作用是_____________
___。
(7)原H2O2溶液中溶质的质量分数是__________
_____ ____。
查看答案和解析>>
科目:高中化学 来源:2013届甘肃省高二上学期期中考试化学(理)试卷 题型:实验题
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
①将碱式滴定管用蒸馏水洗净,再注入待测溶液,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数;将锥形瓶用蒸馏水洗净后,从碱式滴定管中放入20.00mL待测溶液到锥形瓶中。
②将酸式滴定管用蒸馏水洗净,再用标准酸液润洗2-3次后,向其中注入0.1000 mol·L-1标准盐酸,调节滴定管的尖嘴部分充满溶液,并使液面处于"0"刻度以下的位置,记下读数。
③向锥形瓶中滴入指示剂,进行滴定。滴定至终点,记录数据。
④重复以上过程2次。
试回答下列问题:
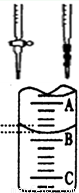
(1)应将NaOH溶液注入右图中的 (选填“甲”或“乙”)中。
(2)该小组在步骤①中的错误是 ,
由此造成的测定结果 (偏高、偏低或无影响)。
(3)右图是某次滴定时的滴定管中的液面,右图表示50mL滴定管中液面的位置,若A与C刻度间相差1mL,A处的刻度为25,滴定管中液面读数应为 mL。
(4)该滴定操作中③应选用的指示剂是 ,滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视? ,如何确定终点? 。
(5)根据下列数据:
|
滴定次数 |
待测液体积(mL) |
标准盐酸体积(mL) |
|
|
滴定前读数(mL) |
滴定后读数(mL) |
||
|
第一次 |
20.00 |
0.52 |
25.42 |
|
第二次 |
20.00 |
4.07 |
29.17 |
请计算待测烧碱溶液的浓度为 。
(6) 如有1mol/L和0.1mol/L的HCl溶液,应用_ _ 的HCl溶液,原因是_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com