
 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.分析 (1)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素;
在同周期中原子的M层电子数比钛原子的M层电子数多8个的过渡元素,说明该过渡元素3d电子层有10电子;
(2)每个Ba原子被8个晶胞占有,每个Ti原子被1个晶胞占有,每个O原子被2个晶胞占有,根据均摊法计算该晶胞中各元素原子个数,从而确定化学式;
(3)根据反应物和生成物及反应条件书写化学方程式;分子晶体熔沸点较低.
解答 解:(1)同一周期元素,第一电离能随着原子序数增大而呈增大趋势,但第IIA族、第VA族元素的第一电离能大于其相邻元素,Ti为第四周期元素,所以钛所在的周期中第一电离能最小的元素是K;
在同周期中原子的M层电子数比钛原子的M层电子数多8个的过渡元素,说明该过渡元素3d电子层有10电子,有Cu、Zn,
故答案为:K;Cu、Zn;
(2)每个Ba原子被8个晶胞占有,每个Ti原子被1个晶胞占有,每个O原子被2个晶胞占有,根据均摊法知,该晶胞中Ba原子个数=8×$\frac{1}{8}$=1、Ti原子个数为1、O原子个数=6×$\frac{1}{2}$=3,其化学式为BaTiO3,故答案为:BaTiO3;
(3)根据反应物和生成物及反应条件书写化学方程式为2Mg+TiCl4$\frac{\underline{\;\;\;\;\;800℃\;\;\;\;\;}}{稀有气体}$2MgCl2+Ti;分子晶体熔沸点较低,该物质熔沸点较低,属于分子晶体,故答案为:2Mg+TiCl4$\frac{\underline{\;\;\;\;\;800℃\;\;\;\;\;}}{稀有气体}$2MgCl2+Ti;分子.
点评 本题考查物质结构和性质,为高频考点,涉及晶胞计算、化学方程式书写、晶体类型判断、原子核外电子排布及元素周期律,综合性较强,明确晶胞结构、元素周期律、晶体类型与熔沸点关系等知识点是解本题关键,易错点是原子核外电子排布.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀硝酸中加入过量铁粉:Fe+4H++NO3-═Fe3++NO↑+2H2O | |
| C. | 铝粉投入到NaOH溶液中:2Al+2OH-═2AlO2-+H2↑ | |
| D. | 氯气与水反应:Cl2+H2O?H++Cl-+HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解精炼铜的过程中,镁转移NA个电子时,阳极溶解铜的质量为32g | |
| B. | 1molNa2O2固体中含离子总数为4NA | |
| C. | 1mol羟基与17g NH3所含电子数之比为9:10 | |
| D. | 1molNa2CO3晶体中含阴离子数小于1NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH计测得某稀盐酸的pH为1.54 | |
| C. | 广泛pH试纸润湿后,测得某溶液的pH为2.3 | |
| D. | 用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
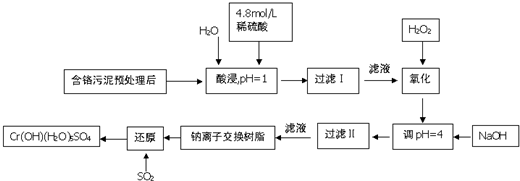
| 阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cr3+ |
| 开始沉淀时的pH | 2.7 | 7.0 | - | - | - |
| 沉淀完全是的pH | 3.7 | 9.0 | 11.1 | 8 | 9(>9溶解) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铷的密度比钠小,熔点比钠高 | |
| B. | 铷与冷水不反应,但与热水反应,并放出氢气 | |
| C. | 铷盐大多数易溶于水 | |
| D. | 铷的原子半径和离子半径都比钠小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 盐酸 | B. | NaCl | C. | AgNO3 | D. | KNO3 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com