
 苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐.某实验小组利用该原理制备纯净的苯甲酸.
| 物质 | 相对分子 质量 | 密度/ (相对于水) | 沸点/℃ | 溶解性 |
| 苯甲醛 | 106 | 1.046 | 178.8 | 微溶于水,可混溶于乙醇、乙醚、苯、氯仿 |
| 苯甲醇 | 108 | 1.042 | 205.7 | 溶于水,易溶于乙醇、醚、芳烃 |
| 苯甲酸 | 122 | 1.271 | 249.2 | 微溶于水,易溶于乙醇、乙醚、氯仿、苯、二硫化碳、四氯化碳 |
| 苯甲酸钠 | 144 | 1.442 | 249.3 | 溶于水和乙醇、甘油、苯、甲醇、微溶于乙醚 |
| 温度/℃ | 25 | 50 | 95 |
| 溶解度/g | 0.17 | 0.95 | 6.8 |
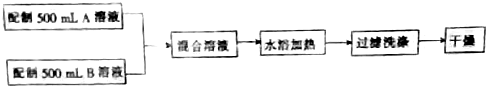
分析 (1)根据装置图可知仪器名称;
(2)根据苯甲酸在水中的溶解度的数据可知,提纯苯甲酸的方法;苯甲酸虽然溶液解度受温度影响较大,但总体溶解度不大,所以增加水可以防止趁热过滤时苯甲酸析出;
(3)纯净的苯甲酸有固定的熔点,其熔点是122.4℃,通过测熔点的方法可判断是否是纯净物;
(4)苯甲醛所取的质量为2.120g,根据苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐,再酸化得苯甲酸,可知理论上能产生苯甲酸的质量为$\frac{2.120g}{106g/mol}×\frac{1}{2}×122g/mol$=1.22g,根据产率=$\frac{实际产量}{理论产量}$×100%计算;
(5)从弃去的萃取有机层中获取笨甲醇,可以用蒸馏的方法,根据蒸馏装置所需要的玻璃仪器答题;
解答 解:(1)根据装置图可知仪器a为三颈烧瓶,仪器 b为(球形)冷凝管,
故答案为:三颈烧瓶;(球形)冷凝管;
(2)根据苯甲酸在水中的溶解度的数据可知,提纯苯甲酸可用重结晶的方法;苯甲酸虽然溶液解度受温度影响较大,但总体溶解度不大,所以增加水可以防止趁热过滤时苯甲酸析出,减少苯甲酸的损失,
故答案为:重结晶;为了减少趁热过滤过程中损失苯甲酸;
(3)纯净的苯甲酸有固定的熔点,其熔点是122.4℃,通过测熔点的方法可判断是否是纯净物,所以检验经操作后得到的是否是纯净的苯甲酸的常用方法是测定获得产品的熔点是否是122.4℃,
故答案为:测定获得产品的熔点是否是122.4℃;
(4)苯甲醛所取的质量为2.120g,根据苯甲醛在浓碱的条件下能发生歧化反应生成苯甲醇和苯甲酸盐,再酸化得苯甲酸,可知理论上能产生苯甲酸的质量为$\frac{2.120g}{106g/mol}×\frac{1}{2}×122g/mol$=1.22g,所以苯甲酸的产率=$\frac{实际产量}{理论产量}$×100%=$\frac{1.098g}{1.22g}$×100%=90.0%,
故答案为:90.0%;
(5)从弃去的萃取有机层中获取笨甲醇,可以用蒸馏的方法,蒸馏装置所需要的玻璃仪器为温度计、尾接管及蒸馏烧瓶、直形冷凝管、锥形瓶,
故答案为:蒸馏烧瓶、直形冷凝管、锥形瓶.
点评 本题考查有机物的合成及混合物的分离,明确反应原理、物质的性质、混合物的分离原理及产率计算方法是解答本题的关键,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | XY2 | B. | X3Y | C. | X2 | D. | Y2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热大于110.5 kJ•mol-1 | |
| B. | 2C(g)+O2(g)═2CO(g)△H>-221 kJ•mol-1 | |
| C. | 98%的浓硫酸与稀氢氧化钠溶液反应生成1mol水的中和热为-57.3kJ•mol-1 | |
| D. | 稀醋酸与稀氢氧化钠溶液反应生成1mol水时放出57.3kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.
CO(NH2)2+H2O.开始以氨碳比$\frac{n(N{H}_{3})}{n(C{O}_{2})}$=3进行反应,达平衡时CO2的转化率为60%,则NH3的平衡转化率为40%.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应4NO2(g)+2NaCl(s)═2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数$\frac{{{k}_{1}}^{2}}{{k}_{2}}$ | |
| B. | 平衡后c(Cl2)=2.5×10-2mol•L-1 | |
| C. | 其他条件保持不变,反应在恒压条件下进行,则平衡常数K2增大 | |
| D. | 平衡时NO2的转化率为50% |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制1 L该溶液,可将0.1 mol CaCl2溶于1 L水中 | |
| B. | Ca2+和Cl-的物质的量浓度都是0.1 mol•L-1 | |
| C. | 从试剂瓶中取该溶液的一半,则所取溶液的物质的量浓度为0.05 mol•L-1 | |
| D. | 将该瓶溶液稀释一倍,则所得溶液的c(Cl-)为0.1 mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com