
 能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.
能源、环境与人类生活和社会发展密切相关,研究它们的综合利用有重要意义.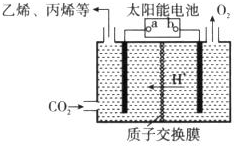
分析 (1)①根据化合价的变化来确定电子转移数目;
②反应方程式中,化学计量数之比等于物质的量之比;
(2)根据盖斯定律进行计算,①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,由②-①×2计算得到;
(3)根据平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积进行计算;
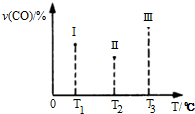
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量,Ⅱ<Ⅰ<Ⅲ,结合化学平衡移动分析解答;
根据温度对平衡的影响来判断,升高温度平衡逆向移动,CO的转化率减小;
(5)太阳能电池为电源,电解强酸性的二氧化碳水溶液得到乙烯,乙烯在阴极生成;
解答 解:(1)①NO+O3═NO2+O2,生成1mol氧气转移电子是2mol,生成11.2L即0.5molO2(标准状况)时,转移电子的物质的量是1mol,故答案为:1;
②当n(NO2):n[CO(NH2)2]=3:2,即NO2和CO(NH2)2的化学计量数之比是3:2,其方程式表示为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2,
故答案为:6NO2+4CO(NH2)2=7N2+8H2O+4CO2;
(2)已知:①NO2(g)+SO2(g)?SO3(g)+NO(g)△H=-41.8kJ•mol-1;
②2SO2(g)+O2(g)?2SO3(g)△H=-196.6kJ•mol-1,
由②-①×2得:2NO(g)+O2(g)=2NO2(g),△H=-196.6kJ•mol-1-2×(-41.8kJ•mol-1)=-113.0 kJ•mol-1,
故答案为:2NO(g)+O2(g)=2NO2(g),△H=-113.0 kJ•mol-1;
(3)2CO2(g)+6H2(g)$\stackrel{催化剂}{?}$CH3OCH3(g)+3H2O(g);
平衡常数等于生成物的浓度幂之积除以反应物的浓度幂之积,所以平衡常数K=$\frac{c(CH{\;}_{3}OCH{\;}_{3})×{c}^{3}(H{\;}_{2}O)}{c{\;}^{2}(CO{\;}_{2})c{\;}^{6}(H{\;}_{2})}$,故答案为:$\frac{c(CH{\;}_{3}OCH{\;}_{3})×{c}^{3}(H{\;}_{2}O)}{c{\;}^{2}(CO{\;}_{2})c{\;}^{6}(H{\;}_{2})}$;
(4)CO(g)+2H2(g)?CH3OH(g)△H<0,该反应正反应为放热反应,根据图3中Ⅰ、Ⅱ、Ⅲ图象,CO百分含量由小到大依次为:Ⅱ<Ⅰ<Ⅲ,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是Ⅲ,
该反应正反应为放热反应,升高温度,平衡逆向移动,若三个容器内的反应都达到化学平衡时,Ⅰ容器温度最低,所以CO转化率最大的反应温度是T1,
故答案为:Ⅲ;T1;
(5)电解时,二氧化碳在b极上生成乙烯,电极反应式为2CO2+12H++12e-=C2H4+4H2O,故答案为:2CO2+12H++12e-=C2H4+4H2O;
点评 本题考查的知识点较多,综合性较强,涉及氧化还原反应、化学方程式和电极反应式的书写、查盖斯定律的应用、平衡常数的计算、以及化学平衡的有关计算知识,难度较大.侧重于影响平衡移动及平衡常数的因素的考查,注意知识的归纳和整理是关键.


科目:高中化学 来源: 题型:选择题
| A. | 家庭用的“84”消毒液与洁厕灵不能同时混合使用,否则会发生中毒事故 | |
| B. | 近期在西非国家爆发的埃博拉疫情呈加速蔓延之势,已知该病毒对化学药品敏感,所以次氯酸钠溶液可以将病毒氧化而达到消毒的目的 | |
| C. | 氯化汞(HgCl2)的稀溶液可用于手术器械消毒,因为它会使蛋白质变性,杀菌消毒 | |
| D. | 煤的主要成分为单质碳、苯、二甲苯等,因而可通过煤的干馏将它们分离 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 物质的量浓度相等的HA和NaA溶液等体积混合,溶液呈碱性:c(A-)<c(HA) | |
| B. | pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3) | |
| C. | pH=3的HCl和pH=11的氨水等体积混合后:c(Cl-)>c(NH4+) | |
| D. | 1.0mol/L Na2CO3溶液:2c(CO32-)+c(HCO3-)+c(OH-)-c(H+)=2.0mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
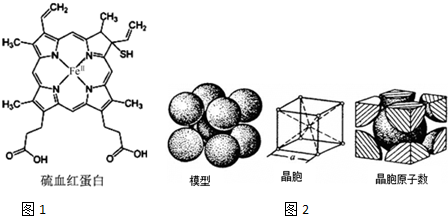
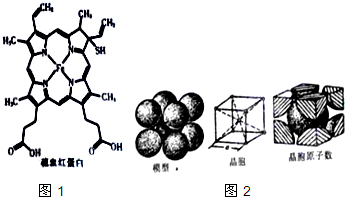 血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题:
血红蛋白是高等生物体内负责运载氧的一种蛋白质(缩写为HB或HCB).与正常血红蛋白相比,硫血红蛋白不能与氧结合,因此失去携带氧的能力.如图1所示为硫血红蛋白的结构.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与 醋酸反应 | CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- | 错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B | 苯酚钠溶液中 通入CO2 | 2C6H5O-+CO2+H2O→2C6H5OH+CO32- | 正确 |
| C | NaHCO3的水解 | HCO3-+H2O=CO32-+H3O+ | 错误,水解方程式 误写成电离方程式 |
| D | 等物质的量的FeBr2和Cl2反应 | 2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | 错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
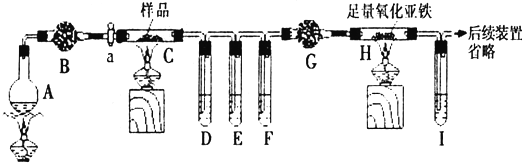
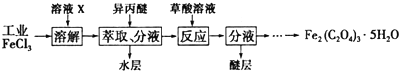
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
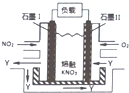 NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )
NO2、O2和熔融KNO3,可制作燃料电池,其原理如图,该电池在使用过程中石墨Ⅰ电极上生成氧化物Y,Y可循环使用.下列说法不正确的是( )| A. | NO2在石墨I附近发生氧化反应 | |
| B. | 该电池放电时N03-向石墨I电极迁移 | |
| C. | 石墨Ⅱ附近发生的反应:O2+4e-+2N205=4 N03- | |
| D. | 相同条件下,放电过程中消耗的NO2和O2的体积比为l:4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com