
在500g稀硝酸中投入48g铁粉,若两种物质恰好完全反应(还原产物为NO)。求:
(1)稀HNO3的质量分数?
(2)被还原的硝酸的物质的量?
(1)若铁不过量,则生成物为Fe(NO3)3
设HNO3的质量为x
Fe + 4HNO3====Fe(NO3)3+NO↑+2H2O
56g 252g
48g x
x=(252g×48g)/56g=216g
HNO3的质量分数=216g/500g×100%=43.2%
![]()
![]()
(2)若铁过量,Fe(NO3)3全部被还原,则生成物为Fe(NO3)2。
设HNO3的质量为y
3Fe + 8HNO3====3Fe(NO3)2+2NO↑+4H2O
168g 504g
48g y
y=(504q×48g)/168g=144g
HNO3的质量分数=144g/500g×100=28.8%
![]()
因此硝酸的质量分数为28.8%≤HNO3%≤43.2%
被还原的硝酸的物质的量为0.57mol≤被还原的HNO3的物质的量≤0.857mol。
本题考查了学生的审题能力。本题看上去简单,实际上很复杂。这是因为硝酸与铁反应时,两者相对量的不同,最终生成物也不一样。若铁与硝酸适量完全反应,则生成Fe(NO3)3;若铁过量,则生成的Fe(NO3)3要与铁反应,而最终生成Fe(NO3)2,第一种情况,消耗硝酸较多,第二种情况消耗的硝酸的量较少(因为铁的质量一定)。若消耗的硝酸的量介于两者之间,即过量不多,则生成和中既有Fe(NO3)2,又有Fe(NO3)3。因此,本题计算的结果不是确定值,而是在一定的范围内,故可分两种情况讨论。


 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:阅读理解
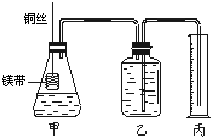 Ⅰ.铜与稀硝酸反应的离子方程式为
Ⅰ.铜与稀硝酸反应的离子方程式为查看答案和解析>>
科目:高中化学 来源: 题型:
(1)用铜屑与稀硝酸反应的实验反应速率较慢,为加快反应的速率,可采取的措施是_______________________________________。
(2)铜与稀硝酸反应的离子方程式:_____________________________;
在做铜与稀硝酸反应的实验时,常观察到试管内生成的气体先为浅红棕色,其原因是_____________________________;
为了能直接观察到生成的气体的颜色,可在往稀硝酸中加入铜的同时,加入少量碳酸盐即可达目的。那么加入碳酸盐的作用是_____________________________。
(3)在做铜与浓硝酸反应的实验时,实验小组为了减少污染,设计了以下四种装置,希望既能观察到反应现象,又能在不拆卸、不增加仪器的情况下使NO2被吸收(注:NaOH溶液可吸收NOx)以避免污染环境。他们设计的装置能达到目的的是___________。(填序号)

(4)实验小组利用上图中的___________装置(填序号),可以在不拆卸、不增加仪器的情况下,用同一装置先后连续完成铜与浓、稀硝酸的反应。要达到此目的,棉球a蘸的物质是___________,液体b为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)假设在任一气体产生的曲线段内,只有一种还原产物,配平b点到c点时反应的方程式_______Fe+_______HNO3![]() _______Fe(NO3)3+_______+_______H2O;
_______Fe(NO3)3+_______+_______H2O;
(2)判断由O点到a点的还原产物是_______;
(3)由a点到b点的还原产物是_______,原因是_______;
(4)已知到达d点时反应完全结束,此时溶液中的主要阳离子为_______,分析投入铁的物质的量之比n(c):n(d)=_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com