
下列热化学方程式书写正确的是(ΔH的绝对值均正确)
A.C(s)+1/2O2(g)=CO(g);ΔH=-110.5kJ·mol-1(燃烧热)
B.2H2O(g)=2H2(g)+O2(g);ΔH=+483.6 kJ·mol-1(反应热)
C.C2H5OH+3O2=2CO2+3H2O;ΔH=-1368.8 kJ·mol-1(反应热)
D.2NaOH(aq)+H2SO4(aq)=Na2SO4 (aq)+2H2O(l);ΔH=-114.6 kJ·mol-1(中和热)
 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014--2015吉林省高一上学期期末化学试卷(解析版) 题型:填空题
(8分)实验室里常用浓盐酸与二氧化锰反应来制取少量的氯气,反应的化学方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
MnCl2+Cl2↑+2H2O。取一定量的浓盐酸使其与二氧化锰发生反应,产生的氯气在标准状况下的体积为22.4 L。
请回答下列问题:
(1)写出该反应的离子反应方程式_____________________________________。
(2)参加反应的二氧化锰的质量为____________。
(3)反应中被氧化的HCl的物质的量为 ____________。
(4)实验室备用的浓盐酸质量分数为36.5%,密度为1.19g·cm-3,为使用方便,请计算出该浓盐酸
的物质的量浓度______________。
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高一1月月考化学试卷(解析版) 题型:选择题
把过氧化钠投入含有HCO3-、Cl-、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3- B.Cl- C.Mg2+ D.Na+
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
已知mX(g)+nY(g) gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
gZ(g)的ΔH<0,在恒容密闭容器中反应达到平衡时,下列说法正确的是
A.升高温度,平衡将正向移动
B.X的正反应速率是Y的逆反应速率的m/n倍
C.降低温度,混合气体的平均相对分子质量变小
D.增加X的物质的量,Y的转化率降低
查看答案和解析>>
科目:高中化学 来源:2014-2015浙江省高二1月月考化学试卷(解析版) 题型:选择题
某温度下,在固定容积的容器中,可逆反应A(g)+3B(g) 2C(g)达到平衡后,若将
2C(g)达到平衡后,若将
平衡体系中各物质的浓度增加一倍,则
A.平衡向逆反应方向移动 B.平衡不移动
C.C的百分含量增大 D.B的浓度减小
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:填空题
(10分,每空2分)现有pH=2的醋酸溶液甲和pH=2的盐酸乙,请根据下列操作回答问题:
(1)取10 mL的甲溶液,加入等体积的水,醋酸的电离平衡________移动(填“向左”、“向右”或“不”);另取10 mL的甲溶液,加入少量无水醋酸钠固体(假设加入固体前后,溶液体积保持不变),待固体溶解后,溶液中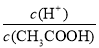 的比值将__________(填“增大”、“减小”或“无法确定”)。
的比值将__________(填“增大”、“减小”或“无法确定”)。
(2)相同条件下,取等体积的甲、乙两溶液,各稀释100倍。稀释后的溶液,其pH大小关系为:pH(甲)________pH(乙) (填“大于”、“小于”或“等于”)。
(3)取25 mL的甲溶液,加入等体积pH=12的NaOH溶液,反应后溶液中c(Na+)、c(CH3COO-)的大小关系为:c(Na+)________c(CH3COO-)。(填“大于”、“小于”或“等于”)。
(4)室温下,现有pH=2的醋酸溶液与PH=12的氨水,等体积混合后,溶液呈中性,则溶液中离子浓度的大小关系:______________
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省淄博市高二12月月考化学试卷(解析版) 题型:选择题
25℃时,在25 mL 0.1 mol·L-1的NaOH溶液中,逐滴加入0.2 mol·Lˉ1的CH3COOH溶液。溶液pH的变化曲线如图所示。下列分析的结论中,不正确的是
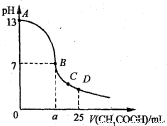
A、C点时c(CH3COO-)>c(Na+)>c(H+)>c(OH—)
B、D点时c(CH3COO-)+c(CH3COOH)=2c(Na+)
C、曲线上A、B间任一点,溶液中都有:c(Na+)>c(CH3COOˉ)>c(OH-)>c(H+)
D、B点的横坐标a=12.5ml
查看答案和解析>>
科目:高中化学 来源:2014-2015山东省平度市高二上学期期中考试化学试卷(解析版) 题型:填空题
(14分)现有反应:mA(g)+ B(g) 2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
2C(g),达到平衡后,当升高温度时,A的转化率变小;当减小压强时,混合体系中C的质量分数不变,则:
(1)该反应的△H 0(填“>”或“<”),且m 1(填“>”“=”“<”)。
(2)若加入B(假设容器的体积不变),则A的转化率 ,B的转化率 。(填“增大”“减小”或“不变”)
(3)若B是有色物质,A、C均无色,则加入C(假设容器的体积不变)时混合物颜色 ,
若维持容器内压强不变,充入氖气时,混合物颜色 (填“变深”“变浅”或“不变”)。
(4)一定温度下,向1L密闭容器中加入1mol C(g)使其分解,气体A的物质的量随时间的变化如下图所示。

则0~2 min内的平均反应速率υ(C)= 。
查看答案和解析>>
科目:高中化学 来源:2014-2015江西省赣州市北校区高二1月月考化学试卷(解析版) 题型:填空题
(14分) (1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为 _____________________ _____________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中C(H2CO3)___ _C( CO32-) (填>、=或<),原因_________ ____
(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=____ ____
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度
为 mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com