
初步提纯下列物质(括号内为少量杂质),选用的试剂和分离方法均正确的是
序号 | 物质 | 试剂 | 分离方法 |
① | 乙酸乙酯(乙酸) | NaOH溶液 | 分液 |
② | 溴苯(溴) | NaOH溶液 | 分液 |
③ | 乙醇(水) | 生石灰 | 蒸馏 |
④ | 苯 (环己烷) | 水 | 分液 |
A.①② B.①③ C.②③ D.④③
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案科目:高中化学 来源:2016届湖南省衡阳市高三上学期第二次月考化学试卷(解析版) 题型:实验题
(16分)实验室测定碳酸钠 和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
和碳酸氢钠混合物中碳酸钠的质量分数W(Na2CO3),称取此混合物5.0g,溶于水中,配成250 mL溶液。
方案一:沉淀法。利用化学反应把HCO3—、CO32—完全转化为沉淀,称量干燥沉淀的质量,由此计算混合物中ω(Na2CO3)。
(1)量取100 mL配制好的溶液于烧杯中,滴加足量沉淀剂,把溶液中HCO3—、CO32—完全转化为沉淀,应选用的试剂是 (填编号)。
A.CaCl2溶液 B.MgSO4溶液 C.NaCl溶液 D.Ba(OH)2溶液
(2)过滤,洗涤沉淀,判断沉淀是否洗净的方法是 ;
(3)将所得沉淀充分干燥,称量沉淀的质量为mg,由此可以计算ω(Na2CO3)。如果此步中,沉淀未干燥充分就称量,则测得ω(Na2CO3) (填“偏大”、“偏小"或“无影响”)。
方案二:量气法。量取10.00 mL配制好的溶液与足量稀硫酸溶液反应,测定生成气体在通常状况(约20℃、1.01×105 Pa)的体积,由此计算混合物中ω(Na2CO3)。
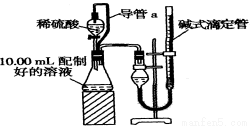
(1)装置中导管a的作用是  。
。
(2)若撤去导管a,使测得气体体积 (“偏大”,“偏小”或“无影响”)。
方案三:滴定法。量取25.00 mL配制好的溶液加入锥形瓶中,滴加2滴酚酞试剂,摇匀,用0.2000 mol/L的盐酸滴定到终点(已知终点时反应H++CO32—=HCO3—恰好完全)。重复此操作2次,消耗盐酸的体积平均值为20.00 mL。
(1)量取25.00 mL配制好的溶液,应选择 仪器来完成。
(2)判断滴定终点的依据是 。
(3)此法测得ω(Na2CO3)= %。
查看答案和解析>>
科目:高中化学 来源:名师精品推荐(解析版) 题型:?????
1 mol过氧化钠与2 mol碳酸氢钠 固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
固体混合后,在密闭容器中加热充分反应,排出气体物质后冷却,残留的固体物质是
A.Na2CO3 B.Na2O2 Na2CO3
C.NaOH Na2CO3 D.Na2O2 NaOH Na2CO3
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期10月月考化学试卷(解析版) 题型:填空题
为了保护环境,充分利用资源,某研究小组通过如下简化流程,将工业制硫酸的硫铁矿烧渣(铁主要以Fe2O3存在)转变成重要的化工原料FeSO4(反应条件略)。

活化硫铁矿还原Fe3+的主要反应为:FeS2+7Fe2(SO4)3+8H2O=15FeSO4+8H2SO4,不考虑其他反应。请回答下列问题:
(1)第Ⅰ步H2SO4与Fe2O3反应的离子方程式是 。
(2)检验第Ⅱ步中Fe3+是否完全还原,应选择 (填字母编号)。
A.KMnO4溶液 B.淀粉-KI溶液 C.KSCN溶液
(3)第Ⅲ步加FeCO3调溶液pH到5.8左右,然后在第Ⅳ步通入空气使溶液pH降到5.2,此时Fe2+不沉淀,滤液中铝、硅杂质除尽。通入空气引起溶液pH降低的原因是 。
(4)FeSO4在一定条件下可制得FeS2(二硫化亚铁)纳米材料。该材料可用于制造高容量锂电池,电池放电时的总反应为4Li+ FeS2= Fe +2Li2S,正极反应式是 。
(5)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25℃,101kPa时:4Fe(s) + 3O2 (g) =2Fe2O3(s)  =-1648kJ/mol
=-1648kJ/mol
C(s)+O2(g)=CO2(g)  =-392kJ/mol
=-392kJ/mol
2Fe(s)+2C(s)+3O2(g)=2FeCO3(s)  =-1480kJ/mol
=-1480kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是 。
(6)假如烧渣中的铁全部视为Fe2O3,其含量为p。将b kg质量分数为c的硫酸加入到a kg烧渣中浸取,铁的浸取率为q,其他杂质浸出消耗的硫酸以及调pH后溶液呈微酸性所残留的硫酸忽略不计。按上述流程,第Ⅲ步应加入FeCO3 kg。
查看答案和解析>>
科目:高中化学 来源:2016届黑龙江省牡丹江市高三9月月考化学试卷(解析版) 题型:选择题
X、Y、Z、W为四种短周期主族元素。其中X、Z同主族,Y、Z同周期,W与X、Y既不同主族也不同周期;X原子最外层电子数是核外电子层数的3倍;Y的最高正价与最低负价的代数和为6。下列说法正确的是
A.X与W形成化合物稳定性一定强于Z与W形成化合物
B.Y、Z两元素的简单离子半径Y>Z
C.X、Y、Z对应气态氢化物的热稳定性和还原性强弱顺序一致
D.Y元素最高价氧化物对应水化物的化学 式为HYO4
式为HYO4
查看答案和解析>>
科目:高中化学 来源:2014-2015学年吉林省高一下期末化学试卷(解析版) 题型:选择题
把①蔗糖,②淀粉,③纤维素,④乙酸乙酯在稀硫酸存在下分别进行水解,最终产物只有1种的是
A.①和② B.只有③ C.只有④ D.只有②和③
查看答案和解析>>
科目:高中化学 来源:2015-2016学年河北省高二9月月考化学试卷(解析版) 题型:填空题
依据事实,写出下列反应的热化学方程式。
(1)在25 ℃、101 kPa下,1 g甲醇燃烧生成CO2和液态水时放热22.68 kJ。则表示甲醇燃烧热的热化学方程式为____________。
(2)写出稀硫酸和稀氢氧化钠溶液反应表示中和热的热化学方程式(中和热为-57.3kJ/mol):_______。
(3)肼可作为火箭发动机的燃料,与氧化剂N2O4反应生成N2和水蒸气。
已知:①N2(g)+2O2(g) =N2O4 (1) △H1= -19.5kJ·mol-1
②N2H4 (1) + O2(g)=N2(g) + 2 H2O(g) △H2= -534.2kJ·mol-1
写出肼和N2O4 反应的热化学方程式_______。
查看答案和解析>>
科目:高中化学 来源:2016届江西省九江市七校高三第一次联考化学试卷(解析版) 题型:选择题
X、Y、Z、W、Q都是短周期元素,其中X原子的最外层电子数是内层电子数的3倍;X与Z同族,Y与Z同周期,Q原子的电子总数等于其电子层数的3倍,W与X、Y既不同族也不同周期且W不为稀有气体元素;X、Y、Z三种元素的族序数之和为16。下列说法正确的是
A.Q与W能形成10电子, 不能形成14电子、18电子分子
B.Y的最高价氧化物对应水化物的化学式只能表示为H4YO4
C.Y、Z、Q分别与X化合,只能形成AB2型化合物
D.X、Z、W中的两种或三种元素形成的钠盐溶液可能显酸性、碱性、中性
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期第一次月考化学试卷(解析版) 题型:选择题
研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在 海水中电池总反应可表示为:5 MnO2+2 Ag+2 NaCl=Na2Mn5O10+2 AgCl。下列关于“水”电池的说法不正确的是
A.AgCl是还原产物
B.负极的电极反应为:Ag+Cl- — e-=AgCl
C.Na+不断向“水”电池的正极移动
D.每生成1mol Na2Mn5O10转移2mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com