
【题目】25℃时,在20 mL 0.1 mol·L-1一元弱酸HA溶液中滴加0. 1 mol· L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与pH关系如图所示。下列说法正确的是

A. A点对应溶液中:c(Na+)>c(A-)>c(H+)>c(OH-)
B. 25℃时,HA酸的电离常数为1. 0× 10-5.3
C. B点对应的NaOH溶液体积为10 mL
D. 对C点溶液加热(不考虑挥发),则c(A-)/[c(HA)c(OH-)]一定增大
【答案】B
【解析】
A. A点对应溶液显酸性,即c(H+)>c(OH-),结合电荷关系判断;
B. pH=5.3时,![]() =0,即c(A-)=c(HA),结合HA酸的电离常数Ka的表达式进行计算;
=0,即c(A-)=c(HA),结合HA酸的电离常数Ka的表达式进行计算;
C. 在20mL HA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,根据题意判断出电离程度与水解程度的大小关系,再分析作答;
D. ![]() =
= ![]() =
=![]() =
=![]() ,Kh为A-的水解常数,据此分析判断。
,Kh为A-的水解常数,据此分析判断。
A. A点对应溶液显酸性,即c(H+)>c(OH-),溶液中电荷守恒关系为c(Na+)+c(H+)=c(A-)+c(OH-),所以离子浓度关系为c(A-)>c(Na+)>c(H+)>c(OH-),A项错误;
B. pH=5.3时,![]() =0,即c(A-)=c(HA),HA酸的电离常数Ka=
=0,即c(A-)=c(HA),HA酸的电离常数Ka=![]() =c(H+)=10-pH=10-5.3,B项正确;
=c(H+)=10-pH=10-5.3,B项正确;
C. 由于Ka=10-5.3>![]() =
= ![]() = Kh,所以20 mLHA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即
= Kh,所以20 mLHA溶液中加入10mL NaOH溶液,得到等浓度的HA和NaA混合溶液,混合溶液以电离为主,使c(A-)>c(HA),即![]() >0,故B点对应的NaOH溶液的体积小于10 mL,C项错误;
>0,故B点对应的NaOH溶液的体积小于10 mL,C项错误;
D. A-的水解常数Kh随温度升高而增大,所以![]() =
= ![]() =
=![]() =
=![]() ,随温度升高而减小,D项错误;
,随温度升高而减小,D项错误;
答案选B。


科目:高中化学 来源: 题型:
【题目】实验室中根据![]() 已知
已知![]() 熔点是16.6℃,沸点44.4℃。设计如下图所示的实验装置制备
熔点是16.6℃,沸点44.4℃。设计如下图所示的实验装置制备![]() 固体。
固体。
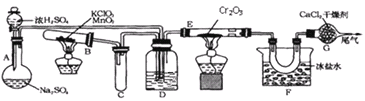
(1)实验开始时,先点燃的酒精灯是_________(填编号)。
(2)装置D中浓硫酸的作用除了混合气体并观察气体流速外还有___________。
(3)装置F的作用是____________________。
(4)由于可逆反应,所以从E管出来的气体中含有![]() 、
、![]() 。为了证明含有
。为了证明含有![]() 可以将该气体通入________(填下列编号,下同)、证明含有
可以将该气体通入________(填下列编号,下同)、证明含有![]() 可以将该气体通入_____________。
可以将该气体通入_____________。
A.品红 B.溴水 C.![]() 溶液 D.
溶液 D.![]() 溶液
溶液
(5)如果没有装置G,则F中可能看到_________________。
(6)从装置G导出的尾气常可以用烧碱或石灰乳吸收。请写出用足量烧碱吸收尾气的离子方程式为:_________________________________________________________。
(7)尾气常采用烧碱或石灰乳吸收,请分析比较两种吸收剂吸收的优点__________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列填空:
(一)下列 8 组物质或粒子:
①14N 和 14C ②16O 和 18O ③氰酸铵(NH4CNO)与尿素[CO(NH2)2] ④足球烯(C60)和金刚石 ⑤CH3CH2CH2CH3 和 CH(CH3)3 ⑥CH3CH2CH3 和 CH3(CH2)2CH3 ⑦ ![]() 和
和 ![]() ⑧
⑧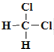 和
和![]()
(1)互为同素异形体的是__________(填编号,下同);
(2)互为同位素的是________________;
(3)互为同系物的是___________;
(4)互为同分异构体的是________________。
(二)有下列几种晶体:
A、水晶 B、冰醋酸 C、白磷 D、金刚石 E、晶体氩 F、干冰 G、氟化钠 H、过氧化钠
(1)属于原子晶体的化合物是__________________(填序号,下同);
(2)含有共价键的离子晶体是________________________;
(3)受热融化时需要克服共价键的晶体是_________________________;
(4)写出下列物质的电子式:过氧化钠_____________,二氧化碳________________。
(三)某烷烃的结构简式为:
(1)用系统命名法命名该烃:__________________________;
(2)若该烷烃是由烯烃加氢得到的,则原烯烃的结构可能有 ________种(不包括立体异构,下同);
(3)若该烷烃是由炔烃加氢得到的,则原快烃的结构有_________________种;
(4)该烷烃在光照条件下与氯气反应,生成的一氧代烷最多有____________种。
(四)火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。 当把 0.4mol 液态肼和0.8mol H2O2 混合反应,生成氮气和水蒸气,放出 256.7KJ 的热量(相当于 25℃、101 kPa 下测得的热量)。
①反应的热化学方程式为________________________________;
②已知 H2O(1)=H2O(g) ΔH=+44kJ/mol。
则 16g 液态肼与液态双氧水反应生成液态水时放出的热量是_________________kJ;
③此反应用于火箭推进,除释放大量热和快速产生大量气体外,还有一个很大的优点是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同分异构现象是有机物之间普遍存在的现象,如分子式为C9H12的有机物存在多种同分异构体,![]() 和异丙苯即为其中两种。
和异丙苯即为其中两种。
(1)![]() 能使Br2的CCl4 溶液褪色,写出其与Br2 发生等物质的量加成反应时可能产物的结构简式___________________、________________、__________________;
能使Br2的CCl4 溶液褪色,写出其与Br2 发生等物质的量加成反应时可能产物的结构简式___________________、________________、__________________;
(2)异丙苯(![]() )是一种重要的有机化工原料,它的1H 核磁共振谱图中出现__________组特征峰,峰强度之比为_____________;
)是一种重要的有机化工原料,它的1H 核磁共振谱图中出现__________组特征峰,峰强度之比为_____________;
(3)C9H12还有多种同分异构体,其中一溴代物最少的芳香烃的结构简式是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2 L密闭容器中充入2 mol N2和10 mol H2发生反应N2+3H2![]() 2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
2NH3。2 min时测得剩余N2的物质的量为1 mol,下列有关化学反应速率的表达不正确的是
A. v(N2)=3 v(H2)B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=0.5mol·L-1·min-1D. 再充入2 mol N2化学反应速率加快
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某芳香烃A,分子式为C8H10;某烃类衍生物X,分子式为C15H14O3,能使FeCl3溶液显紫色;J分子内有两个互为对位的取代基.在一定条件下有如下的转化关系:(无机物略去)
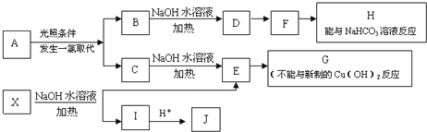
(1)属于芳香烃类的A的同分异构体中,其沸点的大小关系为______;(不包括A,用结构简式表示)
(2)J中所含的含氧官能团的名称为______;
(3)E与H反应的化学方程式是________;反应类型是_______;
(4)B、C的混合物在NaOH乙醇溶液中加热可以生成同一种有机物I,以I为单体合成的高分子化合物的名称是______;
(5)已知J有多种同分异构体,写出一种符合下列性质的J的同分异构体的结构简式_______;
①与FeCl3溶液作用显紫色
②与新制Cu(OH)2悬浊液作用产生红色沉淀
③苯环上的一卤代物有2种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:
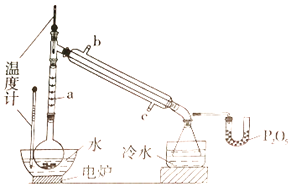
硼酸三甲酯 | 甲醇 | |
溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
沸点/℃ | 68 | 64 |
硼酸三甲酯与甲醇混合物的共沸点为54℃ | ||
Na2B4O7·10H2O+2H2SO4+16CH3OH![]() 2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
2NaHSO4+4[(CH3O)3B+CH3OH]+17H2O
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和19.1gNa2B4O7·10H2O (硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为____________;直形冷凝管冷却水应从____________(填“b”或“c”)接口进入。
(2)本实验加热方式为____________,优点是____________。
(3)加入氯化钙盐析分层的主要目的是____________。
(4)U型管中P2O5的作用是_____________________________________。
(5)步骤④的仪器选择及安装都正确的是____________ (填标号),应收集____________℃的馏分。


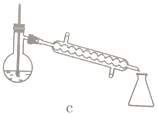
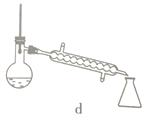
(6)本次实验的产率是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
化合物G是治疗高血压的药物“比索洛尔”的中间体,一种合成G的路线如下:

已知以下信息:
①A的核磁共振氢谱为单峰;B的核磁共振氢谱为三组峰,峰面积比为6∶1∶1。
②D的苯环上仅有两种不同化学环境的氢;1molD可与1mol NaOH或2mol Na反应。
回答下列问题:
(1)A的结构简式为____________。
(2)B的化学名称为____________。
(3)C与D反应生成E的化学方程式为____________。
(4)由E生成F的反应类型为____________。
(5)G是分子式为____________。
(6)L是D的同分异构体,可与FeCl3溶液发生显色反应,1mol的L可与2mol的Na2CO3反应,L共有______种;其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构简式为___________、____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com