
分析 结合n=$\frac{m}{M}$、V=nVm、$ρ=\frac{M}{Vm}$及分子构成计算.
解答 解:同温同压下,Vm相同,同质量的O2和O3,物质的量之比为$\frac{m}{32}$:$\frac{m}{48}$=3:2,则分子数之比为3:2,原子数之比为3×2:2×3=1:1;
由V=nVm可知,体积之比等于物质的量之比,则体积之比为3:2,
由$ρ=\frac{M}{Vm}$可知,密度之比等于摩尔质量之比,则密度之比为32:48=2:3,
故答案为:3:2;1:1; 3:2;2:3.
点评 本题考查物质的量的计算,为高频考点,把握质量、体积、物质的量的关系等为解答的关键,侧重分析与计算能力的考查,注意分子构成及基本计算公式的应用,题目难度不大.


科目:高中化学 来源: 题型:实验题


查看答案和解析>>
科目:高中化学 来源: 题型:实验题
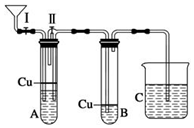 某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:
某化学课外兴趣小组为探究NO气体易被空气氧化,并观察NO气体的实际颜色,同时为了防止气体扩散污染空气,对实验室制取NO气体的装置改装如下:查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解得到的 Cu 的物质的量为 0.5 mol | |
| B. | 向电解后的溶液中加入 98 g 的 Cu(OH)2 可恢复为原溶液 | |
| C. | 原混合溶液中 c(K+)=4 mol/L | |
| D. | 电解后溶液中 c(H+)=2 mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl3具有强氧化性,使血液中的蛋白质被氧化凝固止血 | |
| B. | FeCl3与血液发生化学反应,生成沉淀物质而止血 | |
| C. | FeCl3水解生成Fe(OH)3沉淀而沉积于划破处止血 | |
| D. | FeCl3是电解质,使血液中的蛋白质很快疑结而止血 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由一种元素组成的物质一定是单质 | |
| B. | 任何纯净物都是有一种元素组成的 | |
| C. | 含有氧元素的化合物一定是氧化物 | |
| D. | 有不同种元素组成的纯净物是化合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com