
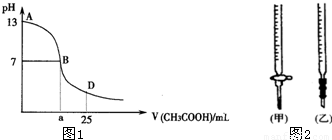
| 锥形瓶中溶液 | 滴定管 中溶液 | 选用 指示剂 | 选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
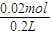 =0.1mol?L-1,所以c(H+)=
=0.1mol?L-1,所以c(H+)=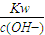 =
=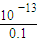 =10-12mol?L-1,PH=12,故答案为:12.
=10-12mol?L-1,PH=12,故答案为:12.

科目:高中化学 来源: 题型:

| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
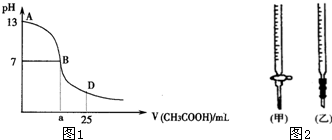
| 锥形瓶中溶液 | 滴定管 中溶液 |
选用 指示剂 |
选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源:2011-2012学年北京四中高二(上)期末化学试卷(解析版) 题型:解答题
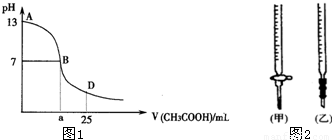
| 锥形瓶中溶液 | 滴定管 中溶液 | 选用 指示剂 | 选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
科目:高中化学 来源:2009-2010学年广东省珠海市香洲区前山中学高三(上)第一次调研化学试卷(解析版) 题型:解答题
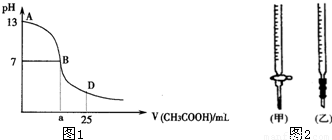
| 锥形瓶中溶液 | 滴定管 中溶液 | 选用 指示剂 | 选用 滴定管 | |
| A | 碱 | 酸 | 石蕊 | (乙) |
| B | 酸 | 碱 | 甲基橙 | (甲) |
| C | 碱 | 酸 | 酚酞 | (甲) |
| D | 酸 | 碱 | 酚酞 | (乙) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com