
【题目】液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。某科研人员设计了以液态肼(N2H4)为燃料,氧气为氧化剂,某固体氧化物为电解质的新型燃料电池(如图所示)。该固体氧化物电解质的工作温度高达700~900℃时,O2-可在该固体氧化物电解质中自由移动,反应生成物均为无毒无害的物质。下列说法正确的是

A. 电极甲为电池正极
B. 电池总反应为N2H4+2O2![]() 2NO+2H2O
2NO+2H2O
C. 电池正极反应式为O2+2H2O+4e-![]() 4OH-
4OH-
D. 图示中的O2-由电极乙移向电极甲
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】对于反应4NH3+5O2===4NO+6H2O,下列为4种不同情况下测得的反应速率,其中能表明该反应进行最快的是( )
A. v(NH3)=0.2 mol·L-1·s-1 B. v(O2)=14 mol·L-1·min-1
C. v(H2O)=0.25 mol·L-1·s-1 D. v(NO)=9 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁和铜都是日常生活中常见的金属,有着广泛的用途。请回答下列问题:
(1)铁在元素周期表中的位置_________。
(2)配合物Fe(CO)n常温下呈液态,熔点为-20.5℃,沸点为103℃,易溶于非极性溶剂,据此可判断Fe(CO)n晶体属于______(填晶体类型)。Fe(CO)n的中心原子价电子数与配体提供电子数之和为18,则n=______ 。Fe(CO)n在一定条件下发生反应:Fe(CO)n(s)![]() Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
Fe(s)+ n CO(g)。已知反应过程中只断裂配位键,则该反应生成物中新形成的化学键类型为___________。
(3)K3[Fe(CN)6]溶液可用于检验________(填离子符号)。CN-中碳原子杂化轨道类型为_________,C、N、O三元素的第一电离能由大到小的顺序为_______(用元素符号表示)。
(4)铜晶体的晶胞如右图所示。
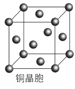
①基态铜原子的核外电子排布式为________________。
②每个铜原子周围距离最近的铜原子数目________。
(5)某M原子的外围电子排布式为3s23p5,铜与M形成化合物的晶胞如附图所示(黑点代表铜原子)。
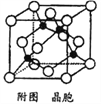
①该晶体的化学式为____________。
②已知该晶体的密度为g.cm-3,阿伏伽德罗常数为NA,则该晶体中铜原子和M原子之间的最短距离为_________pm(只写计算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三盐基硫酸铅(3PbO·PbSO4·H2O)简称三盐,白色或微黄色粉末,稍带甜味、有毒。200℃以上开始失去结晶水,不溶于水及有机溶剂。可用作聚氯乙烯的热稳定剂。以铅泥(主要成分为PbO、Pb及PbSO4等)为原料制备三盐的工艺流程如下图所示。

已知:常温下PbSO4的溶解度比PbCO3的溶解度大
请回答下列问题:
(1)步骤①转化的目的是____________,滤液1中的溶质为Na2CO3和_________(填化学式)。
(2)步骤③酸溶时,为提高酸溶速率,可采取的措施是___________(任写一条)。其中铅与硝酸反应生成Pb(NO3)2和NO的离子方程式为__________________。
(3)滤液2中可循环利用的溶质为__________(填化学式)。
(4)步骤⑥合成三盐的化学方程式为_______________________________________(已知反应中元素价态不变)。
(5)简述步骤⑦洗涤沉淀的方法__________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列电解质溶液有关叙述正确的是
A.恒温条件下稀释氢氟酸时,HF的Ka增大,水的KW不变
B.向Mg(OH)2沉淀悬浊液中加入NH4Cl固体,c(Mg2+)、c(OH-)浓度均增大
C.0.1mol/LNaHCO3溶液中,c(Na+)>c(![]() )>c(
)>c(![]() )>c(H2CO3)
)>c(H2CO3)
D.0.1mol/LNa2SO3溶液中,加入少量NaOH固体,c(![]() )与c(Na+)均增大
)与c(Na+)均增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的应用错误的是
A.可用氧化铁与铝在高温下反应炼铁B.硫化钠与浓硫酸反应可制备硫化氢
C.铁丝在氯气中燃烧可制得无水三氯化铁D.氧化钙与水反应可用作自热米饭加热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲苯(![]() )是一种重要的化工原料,能用于生产苯甲醛(
)是一种重要的化工原料,能用于生产苯甲醛(![]() )、苯甲酸(
)、苯甲酸(![]() )等产品。下表列出了有关物质的部分物理性质,请回答:
)等产品。下表列出了有关物质的部分物理性质,请回答:
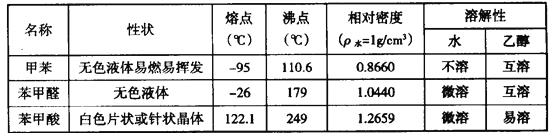
注:甲苯、苯甲醛、苯甲酸三者互溶; 酸性: 苯甲酸>醋酸
实验室可用如图装置模拟制备苯甲醛。实验时先在三颈瓶中加入0.5g固态难溶性催化剂,再加入15mL冰醋酸和2mL甲苯,搅拌升温至70℃,同时缓慢加入12mL过氧化氢,在此温度下搅拌反应3小时。
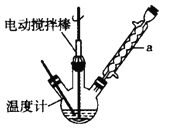
(1)装置a的名称是____ ____,主要作用是 。三颈瓶中发生反应的化学方程式为 ,此反应的原子利用率理论上可达 。
(2)经测定,反应温度升高时,甲苯的转化率逐渐增大,但温度过高时,苯甲醛的产量却有所减少,可能的原因是________________。
(3)反应完毕后,反应混合液经过自然冷却至室温时,还应经过________、________(填操作名称)等操作,才能得到苯甲醛粗产品。
(4)实验中加入过量的过氧化氢并延长反应时间时,会使苯甲醛产品中产生较多的苯甲酸。
①若想从混有苯甲酸的苯甲醛中分离出苯甲酸,正确的操作步骤是_______(按步骤顺序填字母)。
a.对混合液进行分液 b.过滤、洗涤、干燥
c.水层中加入盐酸调节pH=2 d.与适量碳酸氢钠溶液混合震荡
②若对实验①中获得的苯甲酸产品进行纯度测定,可称取1.200g产品,溶于100mL乙醇配成溶液,量取所得的乙醇溶液20.00mL于锥形瓶,滴加2~3滴酚酞指示剂,然后用预先配好的0.1000mol/L KOH标准液滴定,到达滴定终点时消耗KOH溶液18.00mL。产品中苯甲酸的质量分数为________。
③下列情况会使测定结果偏低的是__________(填字母)。
a.滴定终点时俯视读取耗碱量 b.KOH标准液长时间接触空气
c.配制KOH标准液时仰视定容 d.将酚酞指示剂换为甲基橙溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于电解质溶液的正确判断是( )
A. 在pH=12的溶液中,K+、Cl﹣、HCO3﹣、Na+可以大量共存
B. 在pH=0的溶液中,Na+、NO3﹣、SO32﹣、K+可以大量共存
C. 由0.1molL﹣1一元碱BOH溶液的pH=10,可推知BOH溶液存在BOH=B++OH﹣
D. 由0.1molL﹣1一元酸HA溶液的pH=3,可推知NaA溶液存在A﹣+H2OHA+OH﹣
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com