
分析 (1)向Ba(HCO3)2溶液中滴加少量的NaOH溶液,氢氧化钠全反应,按氢氧根全反应来书写,若滴加过量的NaOH溶液,则钡离子和碳酸氢根按照1:2来反应;
(2)根据题目信息,氧化性:Cl2>Br2>Fe3+,氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,先氧化亚铁离子,亚铁离子钡氧化完后再氧化溴离子,根据相关量定量书写方程式.
解答 解:(1)根据少定多变法书写,Ca(HCO3)2溶液和少量的NaOH溶液发生反应的离子方程式为:Ca2++HCO3-+OH-═BaCO3↓+H2O,和过量的NaOH溶液发生反应的离子方程式为:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O,故答案为:Ca2++HCO3-+OH-═CaCO3↓+H2O;Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O;
(2)根据题目信息,氧化性:Cl2>Br2>Fe3+,氯气具有氧化性,能将亚铁离子和溴离子氧化,亚铁离子还原性较强,先氧化亚铁离子,亚铁离子钡氧化完后再氧化溴离子,①当氯气只氧化二甲铁离子时,反应为2Fe2++Cl2=2Fe3++2Cl-,②氯气按比例氧化部分溴离子时2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-,③氯气将两个离子全部氧化时2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-,根据比例关系知,当x≤0.5n时,氯气只氧化二价铁,当0.5n<x<1.5n,二价铁全部被氧化,溴离子部分被氧化,当x≥1.5n,溴离子全部被氧化,故答案为:①2Fe2++Cl2=2Fe3++2Cl-;②2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-;③2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-;④4Fe2++6Br-+5Cl2=4Fe3++3Br2+10Cl-.
点评 本题考查学生离子方程式的定量书写,要求掌握氧化还原的基础知识,熟悉氧化性还原性相对强弱顺序,难度较大.


科目:高中化学 来源: 题型:选择题
| A. | SiO2、SO2均是酸性氧化物,都能与NaOH溶液反应 | |
| B. | Na2O、Na2O2组成元素相同,与CO2反应产物也相同 | |
| C. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 | |
| D. | 二氧化硫有漂白性,通入少量紫色石蕊试液中,充分振荡后溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol•L-1(NH4)2Fe(SO4)2溶液:c (SO42-)>c(NH4+)>c(Fe2+)>c(H+) | |
| B. | 常温下pH=2的HCl溶液与pH=12的氨水溶液等体积混合c(NH4+)=c(Cl-) | |
| C. | 0.2 mol•L-1 Na2CO3溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
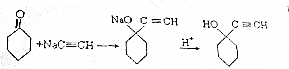
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.50 | 22.60 |
| 第二次 | 20.00 | 1.00 | 24.50 |
| 第三次 | 20.00 | 2.10 | 24.00 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| C6H5Cl(氯苯) | C6H4Cl2 | FeCl3 | FeCl2 | |
| 溶解性 | 不溶于水,易溶于苯 | 不溶于C6H5Cl、C6H4Cl2、苯,易吸水. | ||
| 熔点/℃ | -45 | 53 | -- | -- |
| 沸点/℃ | 132 | 173 | -- | -- |
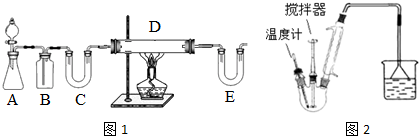
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
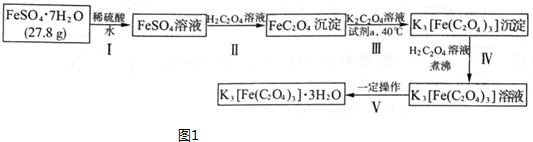
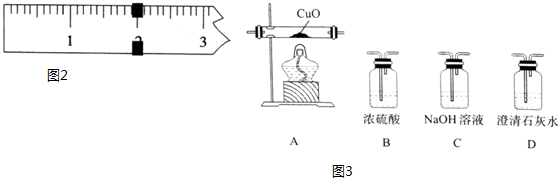
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
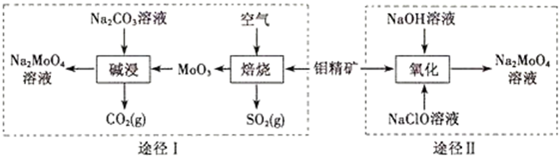

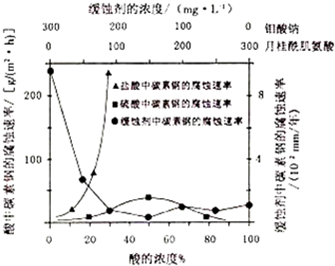
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com