
分析 CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重22.5g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量.
解答 解:产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,
所以n(H2O)=$\frac{22.5g}{18g/mol}$=1.25mol,
根据H原子守恒,可知:n(CH4)=$\frac{1}{2}$n(H2O)=$\frac{1}{2}$×1.25mol=0.625mol,
根据C原子守恒,则:n(CO)+n(CO2)=0.0.625mol,
根据混合物总质量可知:m(CO)+m(CO2)=49.6g-22.5g=27.1g,
则:[0.625mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=27.1g,
解得:n(CO2)=0.6mol,
所以生成二氧化碳的质量为:0.6mol×44g/mol=26.4g,
故答案为:26.4 g.
点评 本题考查混合物的计算,题目难度中等,明确发生反应的实质为解答关键,注意从原子守恒的角度解答,关键根据水的质量判断甲烷的物质的量,试题培养了学生的分析能力及化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Z的气态氢化物稳定性强于其它的非金属气态氢化物 | |
| B. | 原子半径:Z>Y>X | |
| C. | CaY2与水发生氧化还原反应时,CaY2只作氧化剂 | |
| D. | CaX2、CaY2和CaZ23种化合物中,阳离子与阴离子个数比均为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 共价键 | H2分子 | N2分子 | NH3分子 |
| 键能(KJ•mo1-1) | 436 | 945 | 391 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 离子半径 C>D>B>A | B. | 原子序数 d>c>b>a | ||
| C. | 单质的活泼性 A>B,D>C | D. | 原子半径 A>B>D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
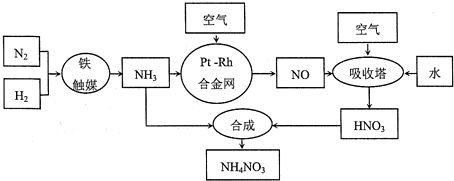
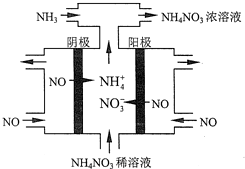
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
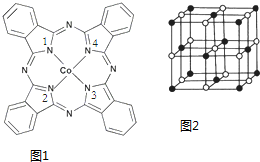
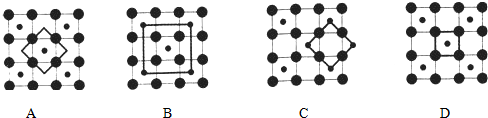
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
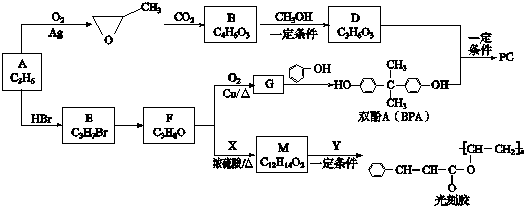
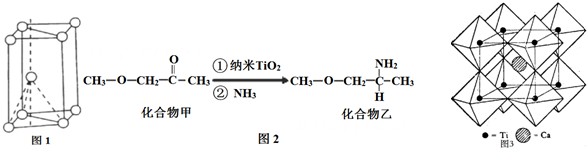
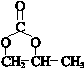 .
.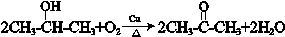 .
.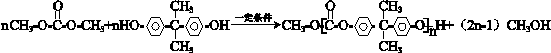 .
.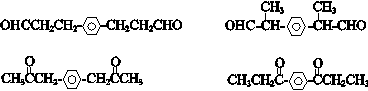 (其中一种).
(其中一种).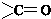 结构
结构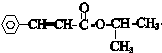 +
+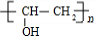 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$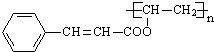 +nCH3CHOHCH3.
+nCH3CHOHCH3.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com