
【题目】我国《可再生能源法》倡导碳资源的高效转化及循环利用。下列做法与上述理念相违背的是
A.大力发展煤的气化及液化技术
B.加快石油等化石燃料的开采和使用
C.以CO2为原料生产可降解塑料
D.将秸秆进行加工转化为乙醇燃料
 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】Ⅰ.化合物Mg5Al3(OH)19(H2O)4可作环保型阻燃材料,受热时按如下化学方程式分解:
2Mg5Al3(OH)19(H2O)4![]() 27H2O↑+10MgO+3Al2O3
27H2O↑+10MgO+3Al2O3
(1)写出该化合物作阻燃剂的两条依据____________。
(2)用离子方程式表示除去固体产物中Al2O3的原理________。
(3)已知MgO可溶于NH4Cl的水溶液,用化学方程式表示其原理____________。
Ⅱ.磁性材料A是由两种元素组成的化合物,某研究小组按如图流程探究其组成:
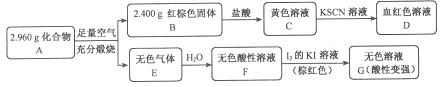
请回答:
(1)A的组成元素为_________(用元素符号表示),化学式为______。
(2)溶液C可溶解铜片,例举该反应的一个实际应用____________。
(3)已知化合物A能与稀硫酸反应,生成一种淡黄色不溶物和一种气体(标况下的密度为1.518 g·L-1),该气体分子的电子式为____。写出该反应的离子方程式__________。
(4)写出F→G反应的化学方程式_____________。设计实验方案探究溶液G中的主要微粒(不考虑H2O、H+、K+、I-)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCN超标的电镀废水可用两段氧化法处理:
(1)NaCN与NaClO反应,生成NaOCN和NaCl
(2)NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2
已知HCN(Ki=6.3×10-10)有剧毒;HCN、HOCN中N元素的化合价相同。
完成下列填空:
(1)第一次氧化时,溶液的pH应调节为____________(选填“酸性”、“碱性”或“中性”);原因是______________________。
(2)写出第二次氧化时发生反应的离子方程式。
_______________________________________
(3)处理100 m3含NaCN 10.3 mg/L的废水,实际至少需NaClO___g(实际用量应为理论值的4倍),才能使NaCN含量低于0.5 mg/L,达到排放标准。
(4)(CN)2与Cl2的化学性质相似。(CN)2与NaOH溶液反应生成_________、__________和H2O。
(5)上述反应涉及到的元素中,氯原子核外电子能量最高的电子亚层是___________;H、C、N、O、Na的原子半径从小到大的顺序为_______。
(6)HCN是直线型分子,HCN是___________分子(选填“极性”、“非极性”)。HClO的电子式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于胶体的叙述中正确的是
A.氯化钠分散到酒精中,形成的分散系不是胶体
B.胶体区别于其他分散系的本质特征是丁达尔效应
C.胶体带电荷,而溶液呈电中性
D.由于土壤胶粒带负电,因此NH4+的肥效比NO3一高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【2016届绵阳三诊】NO能否与Na2O2反应?如果能反应,产物是什么?某兴趣小组对此进行探究。
【查阅资料】①NO不与碱反应;②亚硝酸盐除浅黄色的AgNO2难溶于水外,其余易溶于水;
③2NaNO3![]() 2NaNO2+O2↑,NaNO2热稳定性很高。
2NaNO2+O2↑,NaNO2热稳定性很高。
【实验探究Ⅰ】兴趣小组的同学经讨论设计了如下图所示实验:
(1)仪器a的名称是 ;干燥管D的作用是 。
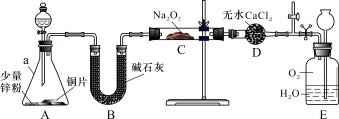
(2)从分液漏斗中加稀硝酸之前,先加入少量稀硫酸让A中锌粉完全溶解,其目的是 。
(3)若无B装置,后果是 。
(4)实验观察到C中固体颜色变白,E中气体先变红棕色,最终又变无色。E中总反应的化学方程式是 。
【实验探究Ⅱ】 该兴趣小组进一步探究C中生成的白色固体的成分。
(5)提出假设:假设1. 白色固体只有NaNO2;假设2. 白色固体只有 ;
假设3. 白色固体是两种物质的混合物。
(6)实验验证:①要证明假设2是否成立,实验操作、现象和结论是____________________。
②为证明是假设1还是假设3成立,称取C中生成的白色固体a g置于坩埚中(坩埚质量为c g),用酒精灯加热至质量不再改变,冷却后称得坩埚和剩余固体总质量为b g,假设3成立时b-c的数字范围是 。(用含a的不等式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G七种前四周期元素且原子序数依次增大,A的最高正价和最低负价的绝对值相等,B的基态原子有3个不同的能级且各能级中电子数相等,D的基态原子与B的基态原子的未成对电子数目相同,E的基态原子s能级的电子总数与p能级的电子数相等,F的基态原子的3d轨道电子数是4s电子数的5倍,G的3d轨道有3个未成对电子,请回答下列问题:
(1)F的基态原子电子排布式为 ,G在周期表的位置 。
(2)B、C、D的原子的第一电离能由小到大的顺序为 (用元素符号回答),A、C、D形成的离子化合物中的化学键类型 。
(3)下列关于B2A2(B原子最外层满足8电子稳定结构)分子和A2D2分子的说法正确的是 。
a.分子中都含有σ键和π键 b.B2A2分子的沸点明显低于A2D2分子
c.都是含极性键和非极性键的非极性分子 d.互为等电子体,分子的空间构型都为直线形
e.中心原子都是sp杂化
(4)用电子式表示E的氯化物的形成过程 。
(5)F的最高正价为+6价,而氧原子最多只能形成2个共价键,试推测CrO5的结构式________。
(6)C的最低价的氢化物为CH3,通常情况下,G2+的溶液很稳定,它与CH3形成的配位数为6的配离子却不稳定,在空气中易被氧化为[G(CH3)6]3+,该反应的离子方程式是 ,1 mol [G(CH3)6]3+配离子含有σ键数目为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一个容积固定为2L的密闭容器中,发生反应aA(g)+bB(g)![]() pC(g)△H=?。反应情况记录如下表:
pC(g)△H=?。反应情况记录如下表:

请仔细分析,根据表中数据回答下列问题:
(1)a= ____________,b= _______________, p=_____________。
(2)第2min到第4min内A的平均反应速率v(A)= _________ molL-1min-1。
(3)由表中数据可知反应在第4min到第6min时处于平衡状态,若在第2min、第6min、第8min时分别改变了某一反应条件,则改变的条件分别可能是:
①第2min:___________ ______或_____________;
②第6min ________________________;
③第8min _______________________ ;
(4)若从开始到第4min建立平衡时反应放出的热量为235.92kJ,则该反应的△H=____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】富马酸(反式丁烯二酸)与Fe2+形成的配合物——富马酸铁又称“富血铁”,可用于治疗缺铁性贫血。以下是合成富马酸铁的一种工艺路线:
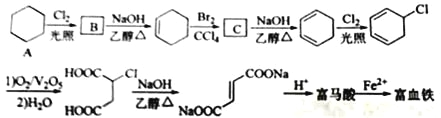
回答下列问题:
(1)A的化学名称为_____;由A生成B的反应类型为_____。
(2)C的结构简式为_____。
(3)富马酸的结构简式为_____。
(4)检验富血铁中是否含有Fe3+的实验操作步骤是_____。
(5)富马酸为二元羧酸,1mol富马酸与足量饱和NaHCO3溶液反应可放出____L CO2(标况);富马酸的同分异构体中,同为二元羧酸的还有____________(写出结构简式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com