
��1������ǣ��Ƽ����Դ�� �����ӡ�
��2����ѧ�Ƶ�ԭ�������û�ѧ��Ӧ���ɽ������ʳ����ڶƼ������γɵĶƲ㡣
������ͭ�ν��л�ѧ��ͭ��Ӧѡ
�� �������������ԭ��������֮��Ӧ��
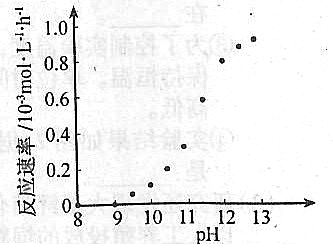
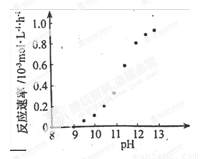
��ij��ѧ��ͭ�ķ�Ӧ�������ҺpH�仯����ͼ��ʾ���ö�ͭ�����У���ҺpH������12.5���ҡ���ͼ����Ϣ������ʹ��Ӧֹͣ�ķ�����
��3���������ȡ����ͭ������ʾ��ͼ���£�
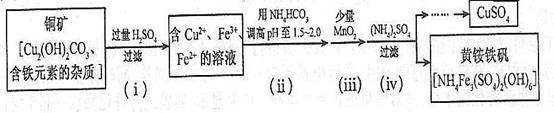
�ٲ��裨i����Cu2(OH)2CO3������Ӧ�Ļ�ѧ����ʽΪ ��
�ڲ��裨ii�������Լ������pH���õ������� (�����ӷ���)��
���ڲ��裨iii�������ķ�Ӧ�У�1molMnO2ת��2��mol���ӣ��÷�Ӧ�����ӷ���ʽΪ ��
�ܲ��裨iv����ȥ���ʵĻ�ѧ����ʽ�ɱ�ʾΪ
![]()
���˺�ĸҺ��pH=2.0��c��![]() ��=a mol��L��1��c��
��=a mol��L��1��c��![]() ��=b mol��L��1��c��
��=b mol��L��1��c��![]() ��=d mol��L��1���÷�Ӧ��ƽ�ⳣ��K= ���ú�a��b��d�Ĵ���ʽ��ʾ����
��=d mol��L��1���÷�Ӧ��ƽ�ⳣ��K= ���ú�a��b��d�Ĵ���ʽ��ʾ����
��������1����Ƴ��У��Ƽ����Ǵ��ƽ����������������Դ�ĸ����������Ʋ����Ϊ���������Դ����������
��2����Ҫ��ͭ��ͭ�����û�ͭ���������������Ϳ��ԣ���������ԭ���ģ����Լ��뻹ԭ����
�ڸ���ͼʾ��Ϣ��pH=8��9֮�䣬��Ӧ����Ϊ0������Ҫʹ��Ӧֹͣ��������Һ��pH��8��9 ֮�䣬�ɼ���ͼ��Ϣ����Ҫ�ԡ�
(3) �ټ�ʽ̼��ͭ�����ᷴӦ�ķ���ʽֱ��д���ù۲취��ƽ��Cu2(OH)2CO3+2H2SO4=2CuSO4+CO2��+3H2O
����ĿҪ�����PH��笠����������ԣ�̼����������Լ��ԣ��������õ�������̼��������ӡ�
���������������ӱ���������ӣ�1mol MnO2ת�Ƶ���2 mol������Ԫ�ش�+4���+2�ۣ���Һ�������Եģ�����ʽ�����۲��Ҫ���������ӣ��ۺ�����������д�����ӷ���ʽΪ��MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O
��������Ũ��Ϊ10-2������K�ı���ʽ���ϾͿ�д����K= ![]() ��
��
24��û���˸��ӵĹ��յ����̣�����ź����ʼ������Ѿ�������û���������������ϰ����������ƽʵ���ѶȲ���ƽ�ⳣ�������ֻҪ���뼴�ɣ�û�и��ӵ���ѧ�任���������Ѷȡ���ͼ����Ϣ�Ļ�ȡҪ��ϸߡ�


 һ������ϵ�д�
һ������ϵ�д� �Ƹ�С״Ԫ���ֳ������ϵ�д�
�Ƹ�С״Ԫ���ֳ������ϵ�д� �¸��̵�ѧϵ�д�
�¸��̵�ѧϵ�д� ����ͬѧһ����ʦȫ�źþ�ϵ�д�
����ͬѧһ����ʦȫ�źþ�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ��2012?��������1�����ʱ���Ƽ����Դ��
��2012?��������1�����ʱ���Ƽ����Դ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��߿���ѧ����ר���̵�8�� �绯ѧ������ϰ���������棩 ���ͣ������
��.��1�����ʱ���Ƽ����Դ��________�����ӡ�
��2����ѧ�Ƶ�ԭ�������û�ѧ��Ӧ���ɽ������ʳ����ڶƼ������γɶƲ㡣����ͭ�ν��л�ѧ��ͭ��Ӧѡ��________(������������������ԭ����)��֮��Ӧ��
��.����[CO(NH2)2]�����������˹��ϳɵ��л���˹�����ɲ��ü�ӵ绯ѧ������ȥ��л�����е����أ�ԭ����ͼ��
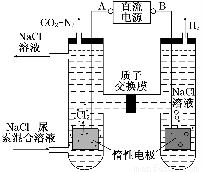
��1����Դ�ĸ���Ϊ________(����A������B��)��
��2���������з����ķ�Ӧ����Ϊ________��________��
��3������������������Һ��pH����ǰ��Ƚ�________�����������ռ�������13.44 L(��״��)�����ȥ������Ϊ________g(����������ܽ�)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012����ͨ�ߵ�ѧУ����ȫ��ͳһ�������ۻ�ѧ���֣������������棩 ���ͣ������
(16��)
(1)���ʱ���Ƽ����Դ�� �����ӡ�
(2)��ѧ�Ƶ�ԭ�������û�ѧ��Ӧ���ɽ������ʳ����ڶƼ������γɶƲ㡣
�� ����ͭ�ν��л�ѧ��ͭ��Ӧѡ�ãߣ������������ԭ��������֮��Ӧ��
�� ij��ѧ��ͭ�ķ�Ӧ�������ҺpH �仯����ͼ��ʾ���ö�ͭ�����У���ҺpH ������12.5���ҡ���ͼ����Ϣ������ʹ��Ӧֹͣ�ķ�����
(3)�������ȡ����ͭ������ʾ��ͼ����
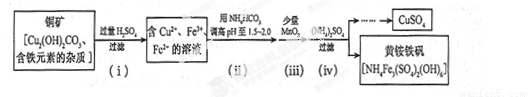
�� ���裨i����Cu2(OH) 2CO3 ������Ӧ�Ļ�ѧ����ʽΪ ��
�� ���裨ii�������Լ������pH ���õ������� �������ӷ��ţ���
�� �ڲ��裨iii�������ķ�Ӧ�У�1 mol MnO2ת��2 mol ���ӣ��÷�Ӧ�����ӷ���ʽΪ ��
�� ���裨iv����ȥ���ʵĻ�ѧ����ʽ�ɱ�ʾΪ
3Fe3+ + NH4++2SO42-+6H2O= NH4Fe3 (SO4)2(OH)6��6H +
���˺�ĸҺ��pH = 2.0 , c (Fe3+) =a mol��L-1��, c ( NH4+��=b mol��L-1��, c ( SO42-��= d mol��L-1���÷�Ӧ��ƽ�ⳣ��K=�� ���ú�a ��b ��d �Ĵ���ʽ��ʾ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2012�긣��ʡ�߿���ѧ�Ծ��������棩 ���ͣ������

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com