
| ag |
| 40g/mol |
| ag |
| 40g/mol |
| ||
| ||


科目:高中化学 来源: 题型:
| 硼晶体的结构单元 | SF6分子 | S8分子 | NaCl | |
| 结构模型示意图 |  |
 |
 |
 |
| 备注 | 熔点1873K | / | 易溶于CS2 | / |
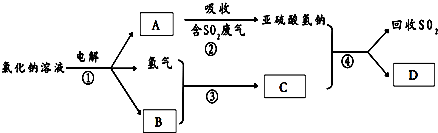
| A、单质硼属分子晶体,其结构单元B12中含有30个B-B键,含20个正三角形 |
| B、SF6是由极性键构成的分子 |
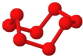
| C、固态硫S8属于原子晶体 |
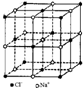
| D、NaCl熔化和溶于水均能产生自由移动的离子,且破坏的是同种作用力,NaCl晶胞中每个Na+周围最近且等距离的Na+有6个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
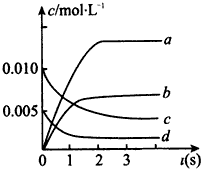 在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
在2L密闭容器内,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如下表所示
| 时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
| N(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验序号 | ① | ② | ③ |
| 压强/Pa | 1×105 | 2×105 | 1×106 |
| c(A)mol?L-1 | 0.08 | 0.16 | 0.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、热稳定性:HCl>HI |
| B、原子半径:Na>Mg |
| C、酸性:H2SO3>H2SO4 |
| D、结合质子能力:S2->Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、酒精的燃烧热△H=-Q3 kJ?mol-1 |
| B、由③可知1mol C2H5OH(g)的能量高于2mol CO2(g)和3mol H2O(g)的总能量 |
| C、H2O(g)→H2O(l)释放出了热量,所以该过程为放热反应 |
| D、23g液体酒精完全燃烧生成CO2(g)和H2O(l),释放出的热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com