
【题目】向NaBr、NaI、Na2SO3混合液中,通入过量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成是( )
A.NaCl、Na2SO4
B.NaCl、NaBr、Na2SO4
C.NaCl、Na2SO4、I2
D.NaCl、NaI Na2SO4
科目:高中化学 来源: 题型:
【题目】下列物质与其用途相符合的是( )
①Cl2-做消毒剂 ②AgBr-制胶卷、感光纸
③AgI-人工降雨 ④碘酸钾-制作加碘盐
⑤淀粉-检验I2的存在 ⑥NaClO-漂白纺织物
A.②③④⑤⑥
B.①②③④⑤
C.②③④⑤
D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某条件下,在2L密闭容器中,X、Y、Z三种气体的物质的量随时间的变化曲线如图所示。下列有关说法不正确的是( )

A.反应2min末X的浓度为0.35mol/L
B.该反应的化学方程式可表示为:2Z2Y+3X
C.反应2min内以Z浓度变化表示的平均反应速率为0.05mol/(Lmin)
D.任何时刻以Z、Y浓度变化表示的反应速率关系符合υ(Z)=υ(Y)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车尾气和燃煤造成空气污染。
(1)CO2是大气中含量最高的一种温室气体,控制和治理CO2是解决温室效应的有效途径.目前,由CO2来合成二甲醚已取得了较大的进展,其化学反应是:2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
CH3OCH3(g)+3H2O(g)△H=+QkJ/mol
①反应的平衡常数和温度的关系如下:
温度/℃ | 700 | 800 | 830 | 1000 | 1200 |
平衡常数 | 0.4 | 0.6 | 1.0 | 1.1 | 1.7 |
写出该反应平衡常数表达式:K=__________。
向一个10L的密闭容器中充入10mol CO2和7molH2,830℃时测得H2为lmol,此时V (正)________V (逆):(选填“>”、“<”)
②判断该反应在一定温度下,体积恒定的密闭容器中达到化学平衡状态的依据是__________。
A. 容器中密度不变
B. 容器内压强保持不变
C.平均摩尔质量保持不变
D.v(CO2) :v(H2) =1:3
E.单位时间内消耗2 mol CO2,同时消耗1 mol二甲醚
F.△H不变
(2)汽车尾气净化的主要原理为2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
2CO2(g)+N2(g)。在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。
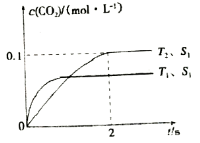
①在T2温度下,0~2 s内的平均反应速率v(N2)=__________;
②当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1〉S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化趋势曲线。
(3)工业上用CO和H2合成 CH3OH:CO (g) +2H2 (g) ![]() CH3OH (g)
CH3OH (g)
①现在容积均为1 L的a、b、c三个密闭容器中分别充入1 mol CO和2 mol H2的混合气体,控制温度进行反应,测得相关数据的关系如图所示。下列说法正确的是____________
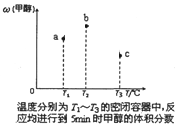
A.正反应的△H>0
B.反应进行到5 min时,b容器中v正=v逆
C.减压可使甲醇的含量由b点变成c点
D.达到平衡时,a、b、c中CO的转化率为b>a>c
②某温度下,在体积固定的4L密闭容器中将1molCO和2molH2混合,测得不同时刻的反应前后压强关系如下:
时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
压强比(p后/p前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
达到平衡时CO的转化率为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】标准状况下,m g气体A与n g气体B的分子数目一样多,下列说法不正确的是()
A. 在任意条件下,若两种分子保持原组成,则其相对分子质量之比为m∶n
B. 25 ℃、1.25×105Pa时,两气体的密度之比为n∶m
C. 同质量的A、B在非标准状况下,其分子数之比为n∶m
D. 相同状况下,同体积的气体A与B的质量之比为m∶n
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.镁铝合金(Mg17Al12)是一种潜在的贮氢材料,可在氩气保护下,将一定化学计量比的Mg、Al 单质在一定温度下熔炼获得。该合金在一定条件下完全吸氢的反应方程式为:Mg17Al12 + 17H2=17MgH2 + 12Al。得到的混合物Y(17MgH2+12Al)在一定条件下可释放出氢气。
⑴ 熔炼制备镁铝合金(Mg17Al12)时通入氩气的目的是
⑵ 在6.0 mol·L-1HCl 溶液中,混合物Y 能完全释放出H2。1 mol Mg17Al12完全吸氢后得到的混合物Y 与上述盐酸完全反应,释放出H2的物质的量为
Ⅱ.某一反应体系有反应物和生成物共五种物质:
O2、H2CrO4、Cr(OH)3、H2O、H2O2
已知该反应中H2O2只发生如下过程:H2O2―→O2
⑴ 该反应中的还原剂是
⑵ 该反应中,发生还原反应的过程是 →
⑶ 写出该反应的化学方程式,并标出电子转移的方向和数目 ;
⑷ 若反应转移了0.3 mol电子,则产生的气体在标准状况下体积为
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com