
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| c(CO2)c(H2) |
| c(CO2)c(H2) |
| c(CO)c(H2O) |
| x×x |
| (0.200-x)×(0.100-x) |
| 2 |
| 30 |
| ||
| 0.200 |
| 1 |
| 3 |
| 1 |
| 3 |


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:
| A、同浓度下列溶液中:①(NH4)2SO4 ②NH4HCO3 ③NH4Cl④NH3?H2O,C(NH4+)由大到小的顺序是:①>③>②>④ |
| B、常温时,将等体积的盐酸和氨水混合后,pH=7,则C(NH4+)>C (Cl-) |
| C、0.2 mol/LNa2CO3溶液中:C (OH-)=C (HCO3-)+C (H+)+C (H2CO3) |
| D、同浓度的下列溶液中,①NaCl ②Na2CO3 ③CH3COONa④NaOH,pH值由大到小的顺序是:④>③>②>① |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol?L-1 H2SO4溶液/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙酸乙酯和水,酒精和水,植物油和水 |
| B、甘油和水,乙酸和水,乙酸和乙醇 |
| C、四氯化碳和水,溴苯和水,硝基苯和水 |
| D、汽油和水,苯和水,乙醛和水 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加热 |
| B、稀硫酸改用98%的浓硫酸 |
| C、滴加少量CuSO4溶液 |
| D、铁片改用铁粉 |
查看答案和解析>>
科目:高中化学 来源: 题型:
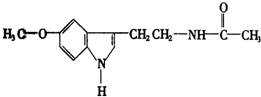 “今年过节不收礼,收礼还收脑白金”,反应了中国人收礼的习俗,脑白金中有效成分的结构简式如图,下列对该化合物的叙述正确的是( )
“今年过节不收礼,收礼还收脑白金”,反应了中国人收礼的习俗,脑白金中有效成分的结构简式如图,下列对该化合物的叙述正确的是( )| A、它属于芳香烃,含有碳碳双键和肽键,能使高锰酸钾溶液和溴水褪色,但原理不同 |
| B、它属于高分子化合物,所有原子不可能共面 |
| C、分子式C13N2H16O2,能和盐酸发生化学反应,体现了一定的碱性 |
| D、在一定条件下可以发生加成反应、氧化反应、水解反应,不能发生酯化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com