
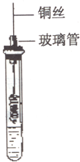
 �Ҵ���һ����Ҫ���л�����ԭ�ϣ������������ס������Ϊԭ�Ͼ����͡������Ƴɣ��Ҵ������;��ӹ������γɵij���ȼ�ϼ��Ҵ����ͣ�����й�֪ʶ���ش��������⣺
�Ҵ���һ����Ҫ���л�����ԭ�ϣ������������ס������Ϊԭ�Ͼ����͡������Ƴɣ��Ҵ������;��ӹ������γɵij���ȼ�ϼ��Ҵ����ͣ�����й�֪ʶ���ش��������⣺���� ��1���Ҵ�������Ʒ�Ӧ�����Ҵ��ƺ�������
��2���Ҵ������ɫ������ͭ��Ӧ�õ���ȩ�ͺ�ɫ��ͭ�Լ�ˮ������ȩ�������ʿ��Ժ�������Һ�Լ����Ƶ�������ͭ����Һ֮�䷴Ӧ��
��3��A���Ҵ������ǽ��Ҵ������ͻ�ϻ��ܺ�����ʣ�
B �Ҵ����͵�ȼ�ղ�����ˮ�Ͷ�����̼��
C������������һ����ɫ�����ܶȱ�ˮС����״Һ�壻
D������CH3CH218OH��CH3COOH����������Ӧ��ԭ���ǣ������ǻ������⣮
��� �⣺��1���Ҵ�������Ʒ�Ӧ�����Ҵ��ƺ�������2CH3CH2OH+2Na��2CH3CH2ONa+H2�����ʴ�Ϊ��2CH3CH2OH+2Na��2CH3CH2ONa+H2����
��2��һ���������״��ͭ˿���ھƾ������м��ȣ�ʹͭ˿��������һ�����ɫ������ͭ��������������ʢ���Ҵ����Թ��������Ӧ��2CH3CH2OH+O2$��_{��}^{����}$2CH3CHO+2H2O������ȩ�������ʿ��Ժ�������Һ�Լ����Ƶ�������ͭ����Һ֮�䷴Ӧ���ֱ�������������Dz���ש��ɫ������
�ʴ�Ϊ����ɺ�ɫ��2CH3CH2OH+O2$��_{��}^{����}$2CH3CHO+2H2O��������Һ������������ͭ��
��3��A���Ҵ������ǽ��Ҵ������ͻ�ϻ��ܺ�����ʣ���һ�ֻ����ʴ���
B �Ҵ����͵�ȼ�ղ�����ˮ�Ͷ�����̼��ʹ���Ҵ����ͣ����Խ�ʡʯ����Դ������β�����ŷţ���������������ȷ��
C���Ҵ������ᷴӦ���ɵ���������������������һ����ɫ�����ܶȱ�ˮС����״Һ�壬����ȷ��
D������CH3CH218OH��CH3COOH����������Ӧ��ԭ���ǣ������ǻ������⣬���������к�18O��
��ѡBC��
���� ���⿼��ѧ���Ҵ��������Լ�Ӧ��֪ʶ��ע��֪ʶ��Ǩ��Ӧ���ǹؼ����Ѷ��еȣ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | SO2ʹ���Ը��������Һ��ɫ | |
| B�� | SO2ʹ���з�̪������������Һ��ɫ | |
| C�� | SO2ʹƷ����Һ��ɫ | |
| D�� | SO2ʹ��ˮ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��Ӧʱ��������pH���� | B�� | ����ܷ�ӦΪ2H2+O2=2H2O | ||
| C�� | O2������������ԭ��Ӧ | D�� | ����ʱOH-���ƶ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=+890 kJ/mol | |
| B�� | CH4��g��+2O2��g��=CO2��g��+2H2O��g����H=-890kJ/mol | |
| C�� | CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-445kJ/mol | |
| D�� | CH4��g��+2O2��g��=CO2��g��+2H2O��l����H=-890kJ/mol |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �����붡�� | B�� | �������춡�� | C�� | ��������� | D�� | 12C��13C |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
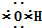
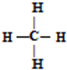
| A�� | �٢� | B�� | �ڢ� | C�� | �ڢ� | D�� | �٢� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ���ͻ����� | B�� | ���������屽 | C�� | �����������Ҵ� | D�� | �Ҵ������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

| ���� | �۵�/�� | �е�/�� | ���� |
| CCl4 | -23 | 76 | ��TiCl4���� |
| TiCl4 | -25 | 136 | ����ʪ������������ |
| TiCl4 | Mg | MgCl2 | Ti | |
| �۵�/�� | -25.0 | 648.8 | 714 | 1667 |
| �е�/�� | 136.4 | 1090 | 1412 | 3287 |
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com