
| A、X只能是第三周期元素 |
| B、a-b+n+m=10或16 |
| C、b不大于6 |
| D、Y不可能是第二周期元素 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:


 (苯胺,易被氧化)
(苯胺,易被氧化) 有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式:
有多种同分异构体,写出同时符合下列4个条件它的同分异构体的结构简式: 的流程图:
的流程图: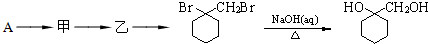 完成甲→乙的化学反应方程式:
完成甲→乙的化学反应方程式:
 为原料
为原料 的合成路线流程图(无机试剂任用).合成路线流程图示例如下:
的合成路线流程图(无机试剂任用).合成路线流程图示例如下:| HBr |
| NaOH溶液 |
| △ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①②③⑤⑦ |
| B、⑤②⑦③⑥ |
| C、⑤②①③④ |
| D、①②⑤③⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不慎将酸溅到眼中,应立即用水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液 |
| C、如果苯酚浓液沾到皮肤上,应立即用酒精洗 |
| D、配制硫酸溶液时,可先在量筒内加入一定体积的水,再在搅拌下慢慢加入浓硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com