

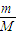 =
=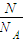 =
=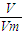 计算;
计算;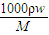 计算浓硫酸的物质的量浓度;
计算浓硫酸的物质的量浓度;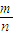 =
=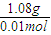 =108g/mol,故答案为:108g/mol;
=108g/mol,故答案为:108g/mol;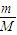 =
=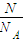 =
=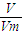 可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则含有分子数目最少的是CO2,在相同温度和相同压强条件下,体积最大的是NH3,故答案为:CO2;NH3;
可知,相同质量时,摩尔质量越大,气体的物质的量越小,体积越小,则含有分子数目最少的是CO2,在相同温度和相同压强条件下,体积最大的是NH3,故答案为:CO2;NH3; :
: =2:1,氧气的摩尔质量为32g/mol,所以气体A的摩尔质量为64g/mol,相对分子质量64,故答案为:64;
=2:1,氧气的摩尔质量为32g/mol,所以气体A的摩尔质量为64g/mol,相对分子质量64,故答案为:64;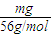 =
=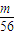 mol,
mol, n(Fe3+)=
n(Fe3+)= ×
×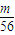 mol=
mol=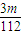 mol,
mol,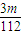 =
=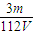 mol/L,故答案为:
mol/L,故答案为: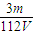 ;
;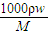 =
=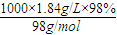 =18.4 mol/L,
=18.4 mol/L,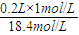 =0.0109L,即10.9ml,故答案为:18.4mol/L;10.9;
=0.0109L,即10.9ml,故答案为:18.4mol/L;10.9;

科目:高中化学 来源: 题型:
 按要求完成下列小题.
按要求完成下列小题.| 3m |
| 112V |
| 3m |
| 112V |
查看答案和解析>>
科目:高中化学 来源:2016届山东省临沂市高一上学期期中考试化学试卷(解析版) 题型:填空题
按要求完成下列小题.
(1)0.5 mol H2O的质量为 g,共有____________个分子,___________个电子。
(2) 0.01mol某物质的质量为1.08g,则此物质的摩尔质量为__________________。
(3)配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4_____________g;需要CuSO4·5H2O _____g。
(4)如图是我校化学实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。

①该浓硫酸的物质的量浓度_____________,
②用该浓硫酸配制200mL1mol/L的稀硫酸,量筒所需量取该浓硫酸的体积是_________mL。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 按要求完成下列小题.
按要求完成下列小题.查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com