
37.(15分) (1)1:2(1分) O<N<F(1分)
(2)3d64s2 (1分) CO2(CS2 N2O)等合理答案都可以(1分) 直线形(1分)
(3)Ca (1分) 8 (1分)
(4)ZnS (2分) 109o28′(1分)
(5)74% (1分);  (2分)
(2分) 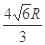 (2分)
(2分)
解析试题分析:A原子的最外层电子是次外层电子数的2倍,故A为碳,D为F,因为氟的电负性最强,则B为N、C为O,F和C在同一族,故F为硫,E与G在周期表的位置是上下相连,两元素所在主族中所有元素都是金属,故F和G在第IIA,为镁和钙,应用最广泛的金属H为铁,在第二副族的I为锌;(1)氮气中氮氮三键,有1条ɑ键,故为1:2,同周期第一电离能从左向右逐渐增大,但氮为半充满,稳定,第一电离能大于氧,故为O<N<F;(2)铁的价电子排布为3d64s2,铁离子与SCN-形成络合物,价电子总数为16,分析可得价电子总数为16的分子为 CO2或CS2 或N2O,分析SCN-的结构可得中心原子碳和硫原子形成一条单键和氮原子形成三键,碳原子共形成2条ɑ键,无孤对电子,故为sp1杂化,直线型;(3)黑点位于面心和顶点,8×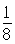 +6×
+6×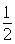 =4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
=4,内部有8个,个数比为1:2,故黑点为钙,选取底面面心的钙,和它距离最近的下面晶胞上有4个,上面有4个,故配位数为8;(4)去掉4个之后变为个数比为1:1的离子化合物,为ZnS的晶体结构,换成一种原子之后,1个原子和四个相同的原子成键,形成正四面体结构,故键角为109o28′;(5)ABAB型六方最密堆积,设圆球半径为R,可以计算出晶胞参数:a="b=2R," c="1.633a," a="b=90°," g=120°
空间利用率=晶胞中球的体积/晶胞体积= 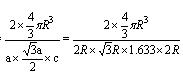 =74.06%;有三个晶胞构成的六棱柱的体积为3a2sin
=74.06%;有三个晶胞构成的六棱柱的体积为3a2sin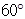 c,晶胞的质量为
c,晶胞的质量为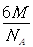 ,质量除以体积得密度为:
,质量除以体积得密度为: ;
;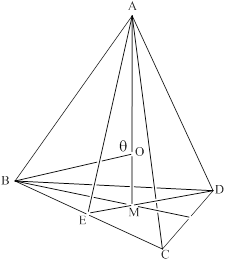 正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :
正四面体的顶点即球心位置,棱长为圆球半径的 2 倍, 四面体的高 :
A3型晶胞中晶轴c 是2个四面体的高,即:c=2AM=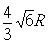 。
。
考点:根据原子结构及元素性质进行元素推断、晶胞的计算、配位数的分析、空间构型的判断等知识。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g) ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g) ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g) ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g) ΔH= kJ/mol (用a.b.c表示)
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知A、B、C是第二周期的非金属元素,其原子序数依次增大,且它们之间可以形成AC和BC以及AC2和BC2分子,D元素是一种短周期元素,它与A、B、C可分别形成电子总数相等的三种分子。请填空:
(1)写出A、B、C、D对应的元素符号:A________、B________、C________、D________。
(2)写出工业生产中BD3与氧气反应的化学方程式:
________________________________________________________________________。
(3)你认为B、C、D元素形成的化合物之间________(填“能”或“不能”)发生下面的反应BC+BD3―→DBC2+D2C,得出上面结论的理由是__________________________ _。
(4)Ⅰ.恒温恒压下,在一体积可变的密闭容器中发生下列反应:4AC(g)+2BC2(g)  4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
4AC2(g)+B2(g)在上述条件下,向容器中充入AC和BC2各1 mol达平衡时,生成AC2和B2共a mol,则AC的转化率是________(用含a的代数式表示)。
Ⅱ. 若维持温度不变,在一个与Ⅰ反应前的起始体积相同,容积固定的密闭容器中发生Ⅰ中所述的化学反应,开始时仍向容器中充入AC和BC2各1 mol,达平衡时生成AC2和B2共b mol,将b与Ⅰ中的a进行比较,则a________b(填“>”“<”“=”或“不能确定”)。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(14分)现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素。X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5。
(1)R元素在周期表中的位置 ;W2X2的电子式 。
(2)X、Y、Z的最低价氢化物中:沸点最高的是 (填化学式);共价键键能最小的是 ;X、Y、Z的杂化类型 (填相同或不相同)。
(3)若R的晶体中每个晶胞平均含有2个R原子,请在下图晶胞中用?标出未画出的R原子。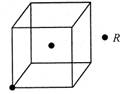
(4)将1.19g ZXY2溶于100ml水中发生非氧化还原反应,生成2种酸,反应方程式为 ;所得溶液中阴离子浓度由大到小的顺序是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
【物质结构与性质】
X、Y、Z、M、N、Q为元素周期表前四周期的六种元素。其中X原子核外的M层中只有两对成对电子,Y原子核外的L层电子数是K层的两倍,Z是地壳内含量(质量分数)最高的元素,M的内层电子数是最外层电子数的9倍,N的原子序数比M小1, Q在元素周期表的各元素中电负性最大。请回答下列问题:
(1)X元素在周期表中的位置是 ,属 区元素,它的最外层电子的电子排布图为 。
(2)XZ2分子的立体结构是 ,YZ2分子中Y的杂化轨道类型为 ,相同条件下两者在水中的溶解度较大的是 (写分子式),理由是 。
(3)含有元素N的盐的焰色反应为 色,许多金属盐都可以发生焰色反应,其原因是 。
(4)元素M与元素Q形成晶体结构如图所示,设其晶胞边长为a pm,则a位置与b位置之间的距离为_______pm(只要求列算式)。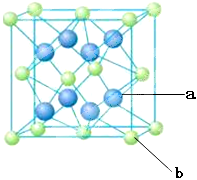
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(12分) A、B、C、D、E、F、G七种元素,试按下列所给条件推断,①A、B、C是同一周期的金属元素,原子核外有三个电子层,A的原子半径在所属周期中最大,且原子半径A>B>C;②D、E是非金属元素,它们跟氢气化合可生成气态氢化物HD和HE,室温时,D的单质是液体,E的单质是固体
③F在常温下是气体,性质稳定,是除氢气外最轻的气态④G是除氢外原子半径最小的元素
(1)A 的名称是 ,B位于周期表中第 周期第 族,C的原子结构示意图是
(2)A元素与D元素形成化合物的电子式是
(3)F的元素符号是
(4)在上述七种元素中,最高价氧化物对应的水化物碱性最强的化学式是 ,酸性最强的化学式是 ,气态氢化物最稳定的化学式是
(5)将C的氧化物对应的水化物投入到A的氧化物对应的水化物中,反应的化学方程式是
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
A、B、C、D、E为原子序数依次增大的五种短周期元素。A和D最外层电子数相同;C、E最低负价相同。B、C的最外层电子数之和等于D的原子核外电子数,A和C可形成两种常见的化合物甲和乙(相对分子质量甲<乙),D2C中阳离子与阴离子的电子层结构相同。请回答下列问题:
(1)B的氢化物与E的氢化物比较,沸点较高的是 (填化学式)。
(2)已知乙能与由A、C、D组成的化合物的溶液反应,请写出反应的离子方程式 。
(3)A、B两种元素可形成一种离子化合物,该离子化合物的电子式为 。
(4)向A、B、C三种元素组成的某盐溶液中滴加AgNO3溶液生成白色沉淀,该反应的化学方程式为____________。已知该盐溶液呈酸性,0.1mol·L-1该盐溶液中离子浓度由大到小的顺序是_________________________。
(5)化合物X、Y由A、C、D、E四种元素中的三种组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比均为1∶1∶1,若X能抑制水的电离,Y能促进水的电离,则X与Y反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
已知A、B、C、D、E都是元素周期表中的前四周期元素,它们原子序数的大小关系为A<C<B<D<E。又知A原子的p轨道为半充满,其形成的简单氢化物的沸点是同主族非金属元素的氢化物中最高的。D原子得到一个电子后其3p轨道将全充满。B+离子比D原子形成的离子少一个电子层。C与B可形成BC型的离子化合物。E的原子序数为29。
请回答下列问题:
(1) 元素A简单氢化物中A原子的杂化类型是________,B、C、D的电负性由小到大的顺序为______(用所对应的元素符号表示)。C的气态氢化物易溶于水的原因是____________________。
(2)E原子的基态电子排布式为________。元素E的单质晶体在不同温度下可有两种堆积方式,晶胞分别如图a和b所示,则其面心立方堆积的晶胞与体心立方堆积的晶胞中实际含有的E原子的个数之比为____________。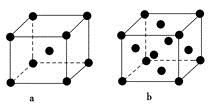
(3)实验证明:KCl、MgO、CaO、TiN这4种晶体的结构与NaCl晶体结构相似(如图所示),其中3种离子晶体的晶格能数据如下表:
| 离子晶体 | NaCl | KCl | CaO |
| 晶格能/kJ·mol-1 | 786 | 715 | 3401 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.含有共价键的化合物一定是共价化合物 |
| B.分子中只有共价键的化合物一定是共价化合物 |
| C.离子键就是阴、阳离子间相互吸引 |
| D.只有非金属原子间才能形成共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com