
| 族 周期 | ⅠA | 0 | ||||||
| 1 | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
| 2 | ③ | |||||||
| 3 | ① | ② | ④ | ⑤ | ||||
分析 由图可知,①为Na,②为Al,③为N,④为S,⑤为Cl,
(1)N位于第二周期第VA族;
(2)非金属性越强,最高价氧化物对应水化物酸性越强;同周期从左向右原子半径减小;
(3)元素①的氢氧化物与元素②的单质反应,生成偏铝酸钠和氢气.
解答 解:由图可知,①为Na,②为Al,③为N,④为S,⑤为Cl,
(1)N位于第二周期第VA族,故答案为:第二周期第VA族;
(2)非金属性越强,最高价氧化物对应水化物酸性越强,④和⑤两种元素的最高价氧化物对应水化物酸性较弱的是H2SO4;同周期从左向右原子半径减小,则②和④两种元素中,原子半径较大的是Al,故答案为:H2SO4; Al;
(3)元素①的氢氧化物与元素②的单质反应,生成偏铝酸钠和氢气,离子反应为2Al+2OH-+2H2O=2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑.
点评 本题考查位置、结构与性质,为高频考点,把握元素的位置、元素化合物知识、元素周期律为解答的关键,侧重分析与应用能力的考查,注意规律性知识的应用,题目难度不大.


科目:高中化学 来源: 题型:解答题
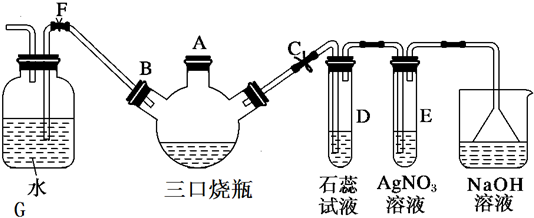

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是元素周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.B原子的p轨道半充满,形成的氢化物的沸点是同主族元素的氢化物中最低的.D原子得到一个电子后3p轨道全充满.A+比D原子形成的离子少一个电子层.C与A形成A2C型离子化合物.E的原子序数为26,E原子或离子外围有较多能量相近的空轨道而能与一些分子或离子形成配合物.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用高效催化剂,可使CO2的平衡转化率增大 | |
| B. | 单位时间内消耗CO2和H2的物质的量比为1:3时,反应达到平衡 | |
| C. | 及时分离出CH3OH和H2O可提高CO2和H2的转化率 | |
| D. | 升高温度可使该反应向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液混合,AgCl和AgI都沉淀 | |
| B. | 若AgNO3足量,AgCl和AgI都可沉淀,但以AgCl为主 | |
| C. | 向AgI的饱和溶液中加AgNO3,c(Ag+)增大,Ksp(AgI)也增大 | |
| D. | 若取0.1435克AgCl固体配成100mL溶液,c(Cl-)为0.01mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | Cl2 | Br2 | I2 | H2 | HCl | HI | HBr |
| 键能/kJ•mol-1 | 243 | 193 | 151 | 436 | 431 | 298 | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 物质 | A | B | C | D |
| 起始投料/mol | 2 | 2 | 3 | 0 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com