

| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ① | B | 浓硫酸、无水乙醇 | 反应器 |
| ② | 无水硫酸铜 | 检出水蒸气 | |
| ③ | C | 品红溶液 | |
| ④ | C | 吸收SO2 | |
| ⑤ | C | 品红溶液 | |
| ⑥ | C | 检出乙烯 | |
| ⑦ | C | 澄清石灰水 | 检出CO2 |
| 序号 | 选用的仪器(填字母) | 加入的试剂 | 作用 |
| ② | A | ||
| ③ | 检验SO2 | ||
| ④ | FeCl3溶液 | ||
| ⑤ | 检验SO2是否除尽 | ||
| ⑥ | 溴水 | ||
| ⑦ |
| 铜或银 |
| 加热 |
| 铜或银 |
| 加热 |
| △ |
| △ |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 实验室用图示装置制取乙酸乙酯.
实验室用图示装置制取乙酸乙酯.| 浓硫酸 |
| 加热 |
| 浓硫酸 |
| 加热 |


查看答案和解析>>
科目:高中化学 来源: 题型:
 在试管甲中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管甲中加入3mL 乙醇,然后边振荡试管边慢慢加入2mL 浓硫酸和2mL 乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.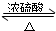 CH3COOC2H5+H2O
CH3COOC2H5+H2O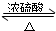 CH3COOC2H5+H2O
CH3COOC2H5+H2O查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:

查看答案和解析>>
科目:高中化学 来源: 题型:
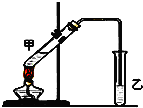 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com