
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. Z元素形成的单质存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
【答案】B
【解析】
四种溶液的物质的量浓度为0.010mol·L-1,根据图像,W对应溶液的pH=2,说明W对应溶液为一元强酸,元素位于第三周期,即W为Cl,X对应溶液的pH=12,则X对应溶液为一元强碱,即X为Na,Z对应水溶液的pH<1,即Z为二元强酸,即Z为S,Y对应的水溶液为酸性,由于H2SiO3难溶于水,故Y为只能P;
四种溶液的物质的量浓度为0.010mol·L-1,根据图像,W对应溶液的pH=2,说明W对应溶液为一元强酸,元素位于第三周期,即W为Cl,X对应溶液的pH=12,则X对应溶液为一元强碱,即X为Na,Z对应水溶液的pH<1,即Z为二元强酸,即Z为S,Y对应的水溶液为酸性,由于H2SiO3难溶于水,故Y只能为P,
A、离子半径大小顺序是P3->S2->Cl->Na+,故A错误;
B、Z为P,P单质有红磷、白磷等,红磷和白磷互为同素异形体,故B正确;
C、非金属性越强,其气态氢化物的稳定性越强,非金属性:Cl>S>P,即气态氢化物稳定性顺序是HCl>H2S>PH3,故C错误;
D、反应后生成Na3PO4,Na3PO4属于强碱弱酸盐,PO43-发生水解,溶液显碱性,故D错误。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】经测定某溶液中只含NH4+、Cl-、H+、OH-四种离子,已知这种溶液中含有一种或两种溶质。查资料表明等物质的量浓度的氨水和氯化铵溶液等体积混合后溶液显碱性,试完成下列各题。
(1)试推测能组成这种溶液的可能的溶质组合有__________种(填数字)。
(2)有关这种溶液,下列说法不正确的是______
A.若溶液中离子间满足c(NH4+)>c(Cl-)>c(OH-)>c(H+),则溶液中溶质一定为NH4Cl 和NH3·H2O
B.若溶液中离子间满足c(Cl-)>c(NH4+)>c(H+)>c(OH-),则溶液中溶质一定只有NH4Cl
C.若溶液中c(NH4+)=c(Cl-),则该溶液一定显中性
D.若溶液中c(NH3·H2O)>c(Cl-),则溶液一定显碱性
(3)若溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)__c(NH3·H2O)(填“>”、“<”或“=”),简述理由_____________。
(4)水的电离程度与溶液中所溶解的电解质有关,如图是用一定浓度的HCl滴定V L同浓度NH3·H2O时得到的滴定曲线。试分析如图所示滴定过程中的a、b、c、d各点,水的电离程度最大的是____________理由为______________________________。

(5)写出a点、c点所对应溶液中各离子浓度由大到小的比较顺序
a点:______________________________________________________________
c点:______________________________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列几组物质中,互为同位素的有__________,互为同素异形体的有__________,互为同系物的有__________,互为同分异构体的有__________,属于同种物质的__________。
①O2和O3 ②35Cl和37Cl③CH3CH3和CH3CH2CH3④CH3CH2CH(CH3)CH2CH3和CH3CH2CH(CH3)CH(CH3)CH3
⑤H2、D2和T2⑥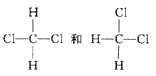 ⑦CH3(CH2)2CH3和(CH3)2CHCH3 ⑧CH3CH(CH3)CH和CH(CH3)3
⑦CH3(CH2)2CH3和(CH3)2CHCH3 ⑧CH3CH(CH3)CH和CH(CH3)3
(2)含有10个及10个以下碳原子的烷烃,其一氯代物只有一种的共有4种,请写出这4种烷烃的结构简式和名称:_______、_______、______、______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示五层膜材料常用于汽车玻璃中的电致变色系统,其工作原理是在外接电源下,通过在膜材料内部发生氧化还原反应,实现对器件的光透过率进行多级可逆性调节。已知WO3和LiFe4[Fe(CN)6]3均为无色透明,LiWO3和Fe4[Fe(CN)6]3均为蓝色。下列有关说法不正确的是

A. 当外电流通过1mol电子时,通过离子导体层的Li+数目为NA
B. 为了获得较好的遮光效果,A应该接电源的负极
C. 该电致变色系统在较长时间的使用过程中离子导体层中Li+的量可保持基本不变
D. 当B接电源正极时,离子储存层反应为:Fe4[Fe(CN)6]3+4Li++4e-= Li4Fe4[Fe(CN)6]3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容容器中,当下列的物理量不再发生变化时,表明反应A(s)+2B(g)C(g)+D(g)已达到平衡状态的是( )
A.混合气体的压强不变
B.v(A):v(B)=1:2
C.B物质的量不变
D.c(B)=c(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列四种元素中,元素的非金属性最强的是( )
A.原子最外层电子数为次外层电子数的2倍
B.第三周期IIIA族元素
C.第16号元素
D.原子核外L层电子数为K层电子数的三倍
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com