
| A. | 氟氯烃作制冷剂会加剧雾霾天气的形成 | |
| B. | 只通过电解的方法就能实现从食盐水到“84”消毒液的生产 | |
| C. | 加碘食盐中含有碘元素,能使淀粉溶液变蓝 | |
| D. | 工业上制漂白粉,所得的氯化物都具有漂白性 |
分析 A.雾霾天气的形成与粉尘污染、汽车尾气有关;
B.电解食盐水得到NaOH和氢气、氯气,氯气和NaOH溶液反应生成次氯酸钠;
C.加碘食盐中含有碘酸钾,碘酸钾不能使淀粉试液变蓝色;
D.工业上制取的漂白粉中含有次氯酸钙和氯化钙,氯化钙没有漂白性.
解答 解:A.氟利昂作制冷剂会导致臭氧空洞,雾霾天气的形成与粉尘污染、汽车尾气有关,故A错误;
B.电解食盐水得到NaOH和氢气、氯气,氯气和NaOH溶液反应生成次氯酸钠,“8.4”消毒液的有效成分是次氯酸钠,故B正确;
C.加碘食盐中含有碘酸钾,碘酸钾不能使淀粉试液变蓝色,所以不能用淀粉试液检验食盐中碘元素,故C错误;
D.工业上制取的漂白粉中含有次氯酸钙和氯化钙,氯化钙没有漂白性,故D错误;
故选B.
点评 本题以化学与生活为载体考查卤素及其化合物的性质,涉及环境污染、物质检验、物质性质等知识点,明确物质的性质是解本题关键,注意漂白粉的有效成分和成分的区别.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
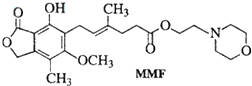
| A. | MMF不溶于水 | |
| B. | MMF能发生氧化反应和消去反应 | |
| C. | 1molMMF能与6mol氢气发生加成反应 | |
| D. | 1molMMF最多能与含3molNaOH的水溶液反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
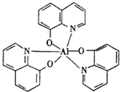 2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8-羟基喹啉铝等.
2012年10月1日起,我国将逐步淘汰白炽灯而采用高效照明的电致发光产品,电致发光材料有掺杂Mn2+和Cu2+的硫化锌、蒽单晶、8-羟基喹啉铝等.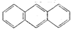 属于非极性(填“极性”“非极性”)分子
属于非极性(填“极性”“非极性”)分子查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙醇(乙酸) 加生石灰,蒸馏 | |
| B. | 乙苯(苯酚) 加浓溴水,过滤 | |
| C. | 溴乙烷(乙醇) 加蒸馏水,分液 | |
| D. | 乙酸乙酯(乙醇) 加乙酸,浓硫酸,加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴定蔗糖水解产物中有葡萄糖:直接在水解液中加入新制Cu(OH)2悬浊液 | |
| B. | 鉴别织物成分是真丝还是人造丝:用灼烧的方法 | |
| C. | 鉴别乙醇、乙酸和乙酸乙酯:用碳酸钠溶液 | |
| D. | 鉴别乙烷和乙烯:将两种气体分别通入溴的四氯化碳溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应的△H>0 | B. | 降低温度,平衡向逆反应方向移动 | ||
| C. | 反应的△H<0 | D. | 升高温度,平衡向正反应方向移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com