
在1.0 L密闭容器中放入0.10 mol A(g),在一定温度进行如下反应:A(g)  B(g)+C(g) ΔH=+85.1 kJ·mol-1
B(g)+C(g) ΔH=+85.1 kJ·mol-1
反应时间(t)与容器内气体总压强(p)的数据见下表:
时间t/h | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | 30 |
| 4.91 | 5.58 | 6.32 | 7.31 | 8.54 | 9.50 | 9.52 | 9.53 | 9.53 |
回答下列问题:
(1)欲提高A的平衡转化率,应采取的措施为________。
(2)由总压强p和起始压强P0计算反应物A的转化率a(A)的表达式为________,平衡时A的转化率为________,列式并计算反应的平衡常数K________。
(3)①由总压强p和起始压强P0表示反应体系的总物质的量n(总)和反应物A的物质的量n(A),n(总)=________mol,n(A)=________mol。
②下表为反应物A浓度与反应时间的数据,计算:a=________。
反应时间t/h | 0 | 4 | 8 | 16 |
c(A)/(mol·L-1) | 0.10 | a | 0.026 | 0.0065 |
分析该反应中反应物的浓度c(A)变化与时间间隔(t)的规律,得出的结论是________,由此规律推出反应在12 h时反应物的浓度c(A)为________mol·L-1。
(1)升高温度、降低压强
(2)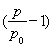 ×100% 94.1%
×100% 94.1%
A(g)  B(g) + C(g)
B(g) + C(g)
起始浓度/mol·L-1 0.10 0 0
转化浓度/mol·L-1 0.10×94.1% 0.10×94.1% 0.10×94.1%
平衡浓度/mol·L-1 0.10×(1-94.1%) 0.10×94.1% 0.10×94.1%
K=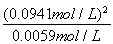 ≈1.5 mol·L-1
≈1.5 mol·L-1
(3)①0.10×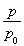 0.10×
0.10×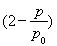 ②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
②0.051 达到平衡前每间隔4 h,c(A)减少约一半 0.013
【解析】通过分析表格中数据,根据压强之比等于物质的量之比入手解决相关问题。
(1)要提高A的转化率,应通过改变条件使平衡正向移动,可以从浓度、温度、压强三个方面考虑,可从容器中分离出B、C或扩大容器的体积(降低压强)或升高温度。
(2)相同条件下,在密闭容器中气体的压强之比等于物质的量之比,设反应后气体的总物质的量为x,则有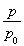 =
=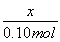 ,x=
,x=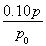 mol,而气体的物质的量的增加量等于消耗的A的物质的量,故A的转化率为
mol,而气体的物质的量的增加量等于消耗的A的物质的量,故A的转化率为 ×100%=(
×100%=(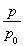 )×100%,将表中的数据代入公式中可得平衡时A的转化率为
)×100%,将表中的数据代入公式中可得平衡时A的转化率为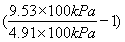 ×100%≈94.1%;根据化学方程式列出平衡三段式,注意三段式中用的都是浓度,即可求得平衡常数。
×100%≈94.1%;根据化学方程式列出平衡三段式,注意三段式中用的都是浓度,即可求得平衡常数。
(3)结合(2)的解析可知n(A)=0.10 mol-(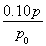 -0.10)mol=0.10×
-0.10)mol=0.10×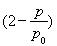 mol;根据表中的数据,可知a=0.10×(2-
mol;根据表中的数据,可知a=0.10×(2-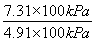 )mol·L-1≈0.051 mol·L-1,通过表中的数据可知,在达到平衡前每间隔4 h,A的浓度减少约一半,故反应在12 h时,A的浓度为0.5×0.026 mol·L-1=0.013 mol·L-1。
)mol·L-1≈0.051 mol·L-1,通过表中的数据可知,在达到平衡前每间隔4 h,A的浓度减少约一半,故反应在12 h时,A的浓度为0.5×0.026 mol·L-1=0.013 mol·L-1。
点拨:知识:外界条件对平衡移动的影响、转化率与压强的关系。能力:考查考生分析数据、加工利用数据的能力以及归纳总结能力。试题难度:较大。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学实验基础练习卷(解析版) 题型:实验题
图中是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
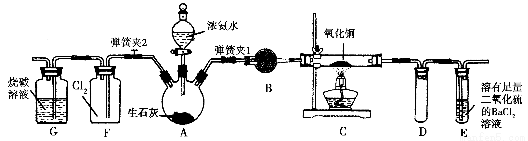
(1)在组装好装置后,若要检验A~E装置的气密性,其操作是首先________,然后微热A,观察到E中有气泡冒出,移开酒精灯或松开双手,E中导管有水柱形成,说明装置气密性良好。
(2)装置B中盛放的试剂是________。
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍候片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产生________(答现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式:________________________。
(4)当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量,若反应前固体质量为16 g,反应后称重固体质量减少2.4 g,通过计算确定该固体产物的成分是_________
__________(用化学式表示)。
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中,写出产生白烟的化学方程式:____________________,迅速产生倒吸的原因是____________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本理论练习卷(解析版) 题型:选择题
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A在反应中既不容易得到电子也不容易失去电子,元素B的原子最外层电子数是其电子层数的3倍,元素D与A为同族元素,元素C与E形成的化合物CE是海水矿物质中的主要成分。下列说法正确的是( )
A.离子半径:E>B>C
B.熔点:CE<DE4
C.C与B形成的两种化合物中化学键类型完全相同
D.A、D、E的最高价氧化物对应水化物的酸性逐渐增强
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
一杯澄清透明的溶液中,已知各离子的浓度均为0.1 mol/L,体积为1 L。可能含有的离子:
阳离子:K+、Fe2+、Ba2+、NH4+ 阴离子:Cl-、NO3—、CO32—、SO42—
向该混合液中加足量稀盐酸,有无色气体生成,且阴离子的种类不变。对该溶液的下列叙述错误的是( )
A.该溶液一定含有Fe2+、NO3—、Cl- B.该溶液一定不含K+、NH4+
C.该溶液一定不含CO32—、Ba2+ D.该溶液可能含有SO42—
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学基本概念练习卷(解析版) 题型:选择题
若用NA表示阿伏加德罗常数的值,下列叙述不正确的是( )
A.1 mol BrCl与H2O完全反应生成氯化氢和次溴酸,转移的电子数为NA
B.锌与一定浓度的浓硫酸反应,产生标准状况下SO2和H2的混合气体22.4 L,锌失去电子数为2NA
C.常温常压下,20 g D2O含有的原子总数为3NA
D.标准状况下,44.8 L NO与22.4 L O2混合后气体中分子总数小于2NA
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学反应速率与化学平衡练习卷(解析版) 题型:选择题
在某恒容密闭容器中进行如下可逆反应:2M(g)+N(g)  W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是( )
W(?)+4Q(g) ΔH<0,起始投料只有M和N。下列示意图正确且能表示该可逆反应达到平衡状态的是( )

查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习必做训练 化学与技术练习卷(解析版) 题型:填空题
煤是重要的能源,也是生产化工产品的重要原料。试用所学知识,解答下列问题:
(1)煤的转化技术包括煤的气化技术和液化技术。煤的液化技术又分为________和________。
(2)在煤燃烧前需对煤进行脱硫处理。煤的某种脱硫技术的原理为FeS2 Fe2++SO42—
Fe2++SO42— Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
Fe3+这种脱硫技术称为微生物脱硫技术。该技术的第一步反应的离子方程式为_____________________________,
第二步反应的离子方程式为____________________。
(3)工业煤干馏得到的产品有焦炭、________。
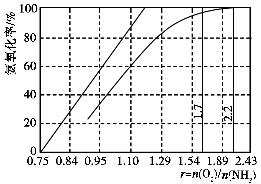
(4)工业上主要采用氨氧化法生产硝酸,如图是氨氧化率与氨-空气混合气中氧氨比的关系。其中直线表示反应的理论值;曲线表示生产实际情况。当氨氧化率达到100%,理论上r[n(O2)/n(NH3)]=________,实际生产要将r值维持在1.7~2.2之间,原因是__________________________________________。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮复习四川配套训练 第7讲水溶液中的离子平衡练习卷(解析版) 题型:填空题
已知在室温的条件下,pH均为5的H2SO4溶液和NH4Cl溶液,回答下列问题:
(1)两溶液中c(H+)·c(OH-)=________。
(2)各取5 mL上述溶液,分别加水稀释至50 mL,pH较大的是________溶液。
(3)各取5 mL上述溶液,分别加热到90 ℃,pH较小的是________溶液。
(4)两溶液中由水电离出的c(H+)分别为:H2SO4溶液:________;NH4Cl溶液:________。
(5)取5 mL NH4Cl溶液,加水稀释至50 mL,c(H+)________10-6 mol·L-1(填“>”、“<”或“=”),  ________(填“增大”、“减小”或“不变”)。
________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com