(2011?江苏)氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
已知:CH
4(g)+H
2O(g)═CO(g)+3H
2 (g)△H=-206.2kJ?mol
-1CH
4(g)+CO
2 (g)═2CO(g)+2H
2 (g)△H=-247.4kJ?mol
-12H
2S(g)═2H
2(g)+S
2(g)△H=-169.8
-1以甲烷为原料制取氢气是工业上常用的制氢方法.CH
4(g)与H
2O(g)反应生成CO
2(g)和H
2(g)的热化学方程式为
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0kJ?mol-1
CH4(g)+2H2O(g)═CO2(g)+4H2(g)△H=-165.0kJ?mol-1
.
(1)H
2S热分解制氢时,常向反应器中通入一定比例空气,使部分H
2S燃烧,其目的是
为H2S热分解反应提供热量
为H2S热分解反应提供热量
;燃烧生成的SO
2与H
2S进一步反应,生成物在常温下均非气体,写出该反应的化学方程式:
2H2S+SO2═2H2O+3S
2H2S+SO2═2H2O+3S
.
(3)H
2O的热分解也可得到H
2,高温下水分解体系中主要气体的体积分数与温度的关系如图1所示.图中A、B表示的物质依次是
氢原子、氧原子
氢原子、氧原子
.
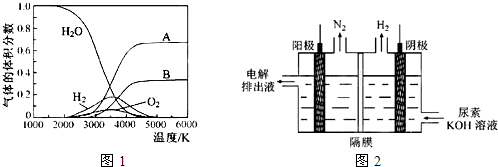
(4)电解尿素[CO(NH
2)
2]的碱性溶液制氢的装置示意图见图2(电解池中隔膜仅阻止气体通过,阴、阳极均为惰性电极).电解时,阳极的电极反应式为
CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O
.
(5)Mg
2Cu是一种储氢合金. 350℃时,Mg
2Cu与H
2反应,生成MgCu
2和仅含一种金属元素的氢化物(其中氢的质量分数为0.077).Mg
2Cu与H
2反应的化学方程式为
.




 (2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29.
(2011?江苏)原子序数小于36的X、Y、Z、W四种元素,其中X是形成化合物种最多的元素,Y原子基态时最外层电子数是其内层电子数的2倍,Z原子基态时2p原子轨道上有3个未成对的电子,W的原子序数为29. (2011?江苏二模)据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )
(2011?江苏二模)据报道,以硼氢化合物NaBH4(B元素的化合价为+3价)和H2O2作原料的燃料电池,负极材料采用Pt/C,正极材料采用MnO2,可用作空军通信卫星电源,其工作原理如图所示.下列说法错误的是( )