
| A、淀粉、纤维素、蛋白质都属于天然高分子形成的混合物 |
| B、蔗糖溶液中加入新制Cu(OH)2煮沸会析出砖红色沉淀 |
| C、纤维素、淀粉都可用(C6H10O5)n表示,它们互为同分异构体 |
| D、人体的各种组织的蛋白质不断分裂,最终生成二氧化碳和水,排出体外 |


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、混合气体的压强 |
| B、混合气体的密度 |
| C、B的物质的量浓度 |
| D、气体总物质的量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、节日燃放的焰火是某些金属元素焰色反应所呈现出来的色彩 |
| B、小苏打是制作馒头和面包等糕点的膨松剂,还是治疗胃酸过多的一种药剂 |
| C、为防止中秋月饼等富脂食品因被氧化而变质,常在包装袋中放入生石灰或硅胶 |
| D、面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于过氧化物,过氧化苯甲酰属于有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、化学反应速率关系是:2υ正(NH3)═3υ正(H2O) |
| B、若升高温度,逆向反应速率增加,正向反应速率减小 |
| C、达到化学平衡时,若增加容器体积,则正反应速率减少,逆反应速率增大 |
| D、达到化学平衡时,4υ正(O2)═5υ逆(NO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、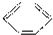 +HONO2 +HONO2
 +H2O +H2O | |||
B、CH3CH3OH+CH3COOH
| |||
C、CH3CH2OH
| |||
| D、BrCH=CHBr+Br2→CHBr2CHBr2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②③ | C、①④ | D、②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com