
【题目】下表为元素周期表的一部分。
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA |
1 | ① | ||||||
2 | ② | ⑤ | |||||
3 | ③ | ⑥ | |||||
4 | ④ | ⑦ | |||||
(1)表中元素________(填写元素符号)的非金属性最强;元素________(填写元素符号)的金属性最强,写出它与水反应的离子方程式__________________________________。
(2)表中元素③的原子结构示意图是________。
(3)表中元素⑥、⑦氢化物的稳定性顺序为________>________(填写化学式,下同)。
(4)表中元素最高价氧化物对应水化物酸性最强的酸的分子式是_________________。
【答案】 F K 2K+2H2O===2K++2OH-+H2↑ 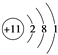 HCl HBr HClO4
HCl HBr HClO4
【解析】根据元素在周期表中的相对位置可知①~⑦分别是H、Li、Na、K、F、Cl、Br。
(1)根据元素周期律可判断表中氟元素的非金属性最强;钾元素的金属性最强,单质钾与水反应的离子方程式为2K+2H2O===2K++2OH-+H2↑。(2)表中元素③是钠,原子结构示意图是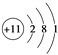 ;(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr。(4)非金属性越强,最高价含氧酸的酸性越强,氟没有含氧酸,则表中元素最高价氧化物对应水化物酸性最强的酸的分子式是HClO4。
;(3)同主族从上到下非金属性逐渐减弱,氢化物稳定性逐渐减弱,则表中元素⑥、⑦氢化物的稳定性顺序为HCl>HBr。(4)非金属性越强,最高价含氧酸的酸性越强,氟没有含氧酸,则表中元素最高价氧化物对应水化物酸性最强的酸的分子式是HClO4。


科目:高中化学 来源: 题型:
【题目】X、Y两根金属棒插入Z溶液中构成如图的装置,实验中电流表指针发生偏转,同时X棒变粗,Y棒变细,则X、Y、Z可能是下列中的( )
编号 | X | Y | Z |
A | Zn | Cu | 稀硫酸 |
B | Cu | Zn | 稀硫酸 |
C | Cu | Ag | 硫酸铜溶液 |
D | Ag | Zn | 硝酸银溶液 |

A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D的原子序数依次增大,其中A、C同主族,B、C、D同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素。试回答下列问题:
(1)A的元素符号__________;D的原子结构示意图_______________。
(2)A、B、C三种元素形成的简单离子的半径由大到小的顺序是(元素符号)__________。
(3)CA2与D元素的单质在水溶液中反应的化学方程式是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是利用废铜屑(含杂质)制备胆矾(硫酸铜晶体)的过程 
已知:
溶液中被沉淀的离子 | Fe3+ | Fe2+ | Cu2+ |
完全生成氢氧化物的沉淀时,溶液的pH | ≥3.7 | ≥6.4 | ≥4.4 |
请回答:
(1)下列物质中最适宜做氧化剂X的是 (填字母).
A.NaClO
B.H2O2
C.KMnO4
(2)加入试剂①是为了调节pH,试剂①可以选择(填化学式).
(3)操作①的名称是 .
(4)沉淀D加入盐酸可以得到FeCl3溶液,关于FeCl3溶液的性质中说法不正确的是 .
A.将FeCl3饱和溶液逐滴加入沸水中,并继续加热得到红褐色液体,该液体能产生丁达尔效应
B.向FeCl3溶液滴加NaOH溶液,出现红褐色沉淀
C.将FeCl3溶液滴加NaOH溶液,将沉淀干燥灼烧,得到Fe(OH)3固体
D.向FeCl3溶液中滴加KSCN溶液,溶液变为红色
(5)沉淀D加入盐酸和铁粉,可以制得FeCl2溶液,实验室保存FeCl2溶液,需加入过量的铁粉防止FeCl2溶液变质,其原因是(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某待测溶液中可能含有SO42﹣、SO32﹣、CO32﹣、HCO3﹣、NO3﹣、Cl﹣、Br﹣中的若干种及一种常见金属阳离子(Mn+),现进行如下实验(每次实验所用试剂均是足量的,鉴定中某些成分可能没有给出).
请回答下列问题:
(1)根据上述框图信息填写下表(不能确定的不填):
肯定存在的离子 | 肯定没有的离子 | |
化学式或离子符号 |
(2)出沉淀A三种可能的情况: , 若气体D遇空气变红棕色,则生成沉淀D时肯定发生的反应的离子方程式为 .
(3)若Mn+位于第三周期,则要确定它具体是何种离子的方法是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氧化钠和过氧化钠的叙述中正确的是
A. 都能与氧气反应 B. 溶于水后,所得溶液的成分相同
C. 都能与水发生化合反应 D. 分别与二氧化碳反应,生成不同的盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有aW、bX、cY、dZ四种短周期元素,已知![]() ,且W、X、Y的最外层电子数总和大于Z的最外层电子数。下列说法不正确的是
,且W、X、Y的最外层电子数总和大于Z的最外层电子数。下列说法不正确的是
A. W元素的单质常温下是气体
B. X是蛋白质的组成元素之一
C. Y元素的单质能与冷水发生剧烈反应
D. Z元素的气态氢化物的水溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种短周期主族元素,原子序数由A到E逐渐增大.①A元素最外层电子数是次外层电子数的2倍.②B的阴离子和C的阳离子与氖原子的电子层结构相同.③在通常状况下,B的单质是气体,0.1mol B的气体与足量的氢气完全反应共有0.4mol电子转移.④C的单质在点燃时与B的单质充分反应,生成淡黄色的固体,此淡黄色固体能与AB2反应可生成B的单质.⑤D的气态氢化物与其最高价含氧酸间能发生氧化还原反应.请写出:
(1)A元素的最高价氧化物的结构式;B元素在周期表中的位置 .
(2)C单质在B单质中燃烧的生成物中所含化学键类型有;C与D 能形成化合物的电子式 .
(3)D元素的低价氧化物与E的单质的水溶液反应的化学方程式为 .
(4)元素D与元素E相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是(填选项序号). a.常温下D的单质和E的单质状态不同 b.E的氢化物比D的氢化物稳定
c.一定条件下D和E的单质都能与钠反应 d.D的最高价含氧酸酸性弱于E的最高价含氧酸
e.D的单质能与E的氢化物反应生成E单质.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知实验室在加热条件下制取Cl2的化学方程式为:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
MnCl2+Cl2↑+2H2O。现将8.7 g MnO2投入到200 g质量分数为36.5%(过量)的浓盐酸中加热,充分反应后,求:
(1)标准状况下生成Cl2的体积。
(2)反应生成的MnCl2的质量为。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com