
| ||
| ||
| ||
| ||
| ||
| ||
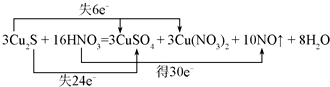 ,
, .
.


科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].
(1)人们常用催化剂来选择反应进行的方向.如图所示为一定条件下1mol CH3OH与O2发生反应时,生成CO、CO2或HCHO的能量变化图[反应物O2(g)和生成物H2O(g)略去].| 温度(℃) | 250 | 300 | 350 |
| K | 2.041 | 0.270 | 0.012 |
| 时间(min) | 5 | 10 | 15 | 20 | 25 | 30 |
| 压强比(P后/P前) | 0.98 | 0.90 | 0.80 | 0.70 | 0.70 | 0.70 |
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 饱和醇的质量 | 金属钠的质量 | 量气管第一次读数 | 量气管第二次读数 | |
| ① | 0.62g | 5.0g(足量) | 40mL | 264mL |
| ② | 0.31g | 2.5g(足量) | 40mL | 152mL |
查看答案和解析>>
科目:高中化学 来源: 题型:
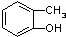 和
和 ⑥
⑥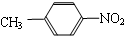 和
和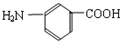
查看答案和解析>>
科目:高中化学 来源: 题型:
A、
| |||||
B、
| |||||
C、
| |||||
D、
|
查看答案和解析>>
科目:高中化学 来源: 题型:
 人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图所示,下列说法正确的是( )
人工肾脏可用间接电化学方法除去代谢产物中的尿素[CO(NH2)2],即通过阳极反应生成具有强氧化作用的中间产物来氧化代谢产物,原理如图所示,下列说法正确的是( )| A、B为电源的正极 |
| B、电解过程中,阳极室附近的PH保持不变 |
| C、电解过程中,电子由电源B端流出经溶液流回到电源A端 |
| D、右边发生的电极反应式为:2H2O+2e-═H2↑+2OH- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com