
 电石气的结构式H-C≡C-H
电石气的结构式H-C≡C-H .
. .
.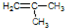 .
. 分析 (1)甲基中含有3个碳氢键,碳原子最外层为7个电子,据此写出甲基的电子式;结构式中体现碳碳三键、单键;
(2)根据烷烃的命名原则对该有机物进行命名;
(3)①2,3-二甲基-4-乙基已烷的主链上有6个碳原子,在2号和3号碳原子上各有一个甲基,在4号碳原子上有一个乙基;
②烷烃中含有取代基乙基,则主链至少含有5个C原子,据此写出满足条件的烷烃的结构简式;
(4)这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56,计算2.8g有机物的物质的量,结合生成水和二氧化碳的质量可计算有机物的分子式,并以此确定有机物同分异构体的结构简式.
解答 解:(1)甲基中碳原子最外层为7个电子,甲基的电子式为: ;电石气即乙炔,而乙炔的结构简式为H-C≡C-H,故答案为:
;电石气即乙炔,而乙炔的结构简式为H-C≡C-H,故答案为: ;H-C≡C-H;
;H-C≡C-H;
(2)CH3CH(C2H5)CH(CH3)2,该有机物为烷烃,最长碳链含有5个C,主链为戊烷,变化从右边开始,在2、3号C各含有应该甲基,该有机物命名为:2,3-二甲基戊烷,故答案为:2,3-二甲基戊烷;
(3)①2,3-二甲基-4-乙基已烷的结构简式为 ,故答案为:
,故答案为: ;
;
②采用知识迁移的方法解答,该烷烃相当于甲烷中的氢原子被烃基取代,如果有乙基,主链上碳原子最少有5个,所以该烃相当于甲烷中的3个氢原子被乙基取代,故该烃的结构简式 ,故答案为:
,故答案为: ;
;
(4)①这种有机物蒸气的质量是同温同压下同体积N2的2倍,则该有机物的相对分子质量为2×28=56;
n(A)=$\frac{2.8g}{2×28g/mol}$=0.05mol,
n(C)=n(CO2)=$\frac{8.8g}{44g/mol}$=0.2mol,
n(H)=2n(H2O)=2×$\frac{3.6g}{18g/mol}$=0.4mol,
故有机物分子中含有C原子数目为$\frac{0.2mol}{0.05mol}$=4,含有H原子数目为$\frac{0.4mol}{0.05mol}$=8,
因为12×4+1×8=56=M(A),所以没有O元素;
∴分子式为C4H8,
故答案为:C4H8;
②已知分子式为C4H8,且为链状结构,则分子中有一个C=C,则结构简式为:CH2=CHCH2CH3,CH3CH=CH2CH3 ,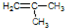 ,
,
故答案为:CH2=CHCH2CH3;CH3CH=CH2CH3 ;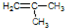 .
.
点评 本题考查有机物的推断,侧重于学生的分析、计算能力的考查,题目难度不大,本题注意根据有机物生成的二氧化碳和水的质量结合相对分子质量可判断有机物的分子式,注意有机物的结构特点.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | 含20.0 g NaOH的稀溶液与稀盐酸完全中和,放出28.7 kJ的热量,该反应的热化学方程式是 NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l)△H=+57.4 kJ•mol-1 | |
| B. | 已知C(石墨,s)=C(金刚石,s)△H>0,则金刚石一定比石墨稳定 | |
| C. | 已知:断裂1mol H2(g)、1molCl2(g)、1molHCl(g)中化学键吸收的能量分别是E1、E2、E3,则H2(g)+Cl2 (g)=2HCl(g)的反应热△H=2×E3-(E1+E2) | |
| D. | 已知C(s)+O2(g)=CO2(g)△H=a kJ•mol-1,2C(s)+O2(g)=2CO(g),△H=b kJ•mol-1,则2CO(g)+O2(g)=2CO2(g)△H=(2a-b) kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
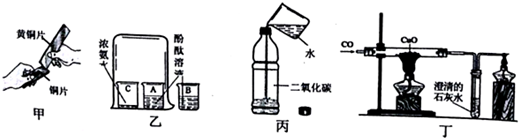
| A. | 甲实验中黄铜片能在铜片上刻画出痕迹可以说明黄铜的硬度比铜片大 | |
| B. | 乙实验既可以说明分子在不停的运动着,又可以说明氨水显碱性 | |
| C. | 丙实验既可以说明二氧化碳易溶于水,又可以说明二氧化碳具有酸性 | |
| D. | 丁实验既可以说明一氧化碳具有还原性,又可以说明一氧化碳具有可燃性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 正极 | Zn | Ag | C | Cu |
| 负极 | Cu | Cu | Zn | Zn |
| 电解质溶液 | CuCl2 | H2SO4 | CuSO4 | FeCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
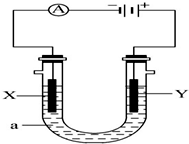 电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞溶液,请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
序号 | 时间/min 物质的量/mol 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 |
| 1 | 800 | 1.0 | 0.80 | 0.67 | 0.57 | 0.50 | 0.50 |
| 2 | 800 | 1.0 | 0.60 | 0.50 | 0.50 | 0.50 | 0.50 |
| 3 | 820 | 1.0 | 0.40 | 0.25 | 0.20 | 0.20 | 0.20 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com