
| A. | 1 mol聚乙烯含有的原子数目为6NA | |
| B. | 标准状况下,11.2L CHCl3中所含有的原子总数为2.5NA | |
| C. | 一定条件下,2.6 g乙炔、苯和苯乙烯的气态混合物中所含碳原子数为0.2NA | |
| D. | 1 mol甲基含10 NA个电子 |
分析 A、聚乙烯的分子式中聚合度n的值不明确;
B、标况下三氯甲烷为液态;
C、乙炔、苯和苯乙烯的最简式均为CH;
D、甲基为-CH3,不显电性.
解答 解:A、聚乙烯的分子式中聚合度n的值不明确,故1mol聚乙烯中含有的原子个数无法计算,故A错误;
B、标况下三氯甲烷为液态,故不能根据气体摩尔体积来计算其物质的量和原子个数,故B错误;
C、乙炔、苯和苯乙烯的最简式均为CH,故2.6g混合物中含有的CH的物质的量为0.2mol,故含0.2NA个碳原子,故C正确;
D、甲基为-CH3,不显电性,故1mol甲基中含9NA个电子,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2+2H218O═4NaOH+18O2↑ | |
| B. | CH3COOH+CH3CH218OH→CH3COOCH2CH3+H218O | |
| C. | 5H218O2+2KMnO4+3H2SO4═518O2↑+K2SO4+2MnSO4+8H2O | |
| D. | K37ClO3+6HCl═K37Cl+3Cl2↑+3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 食品化学家认为,当豆油被加热到油炸温度(180℃)时,会产生如图所示的高毒物质,许多疾病和这种有毒物质有关.下列关于这种有毒物质的判断错误的是( )
食品化学家认为,当豆油被加热到油炸温度(180℃)时,会产生如图所示的高毒物质,许多疾病和这种有毒物质有关.下列关于这种有毒物质的判断错误的是( )| A. | 该物质的分子式为C9H16O2 | |
| B. | 该物质能发生银镜反应 | |
| C. | 该物质能发生水解反应 | |
| D. | 该物质1mol最多可以和2mol H2发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 甲 组 | 乙 组 | ||
| 实验步骤 | 实验现象 | 实验步骤 | 实验现象 |
| 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. | 1.取两支试管,加入3mL水,各滴入2滴酚酞试液,分别加入一小粒金属钠和少量镁粉,观察现象. 将加入镁粉的试管加热至沸腾,观察现象. | 钠:在冷水中,浮于水面,熔成小球,四处游动,逐渐缩小,溶液很快变红色. 镁:在冷水中几乎无现象,加热至沸后产生大量气体,溶液变红. |
| 2.取一小块铝和一小块镁带,用砂纸擦去表面的氧化膜,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:剧烈反应,很快产生大量气体. 铝:也产生大量气体,但反应比镁慢. | 2.取一小块铝和一小块镁带,分别同时投入盛有2mL1mol/L盐酸的两个试管中,观察现象. | 镁:开始时没有现象,过一会儿产生大量气体. 铝:基本没有变化. |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
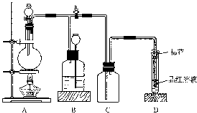 如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:
如图所示装置为铜跟浓硫酸反应制取二氧化硫的实验装置:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 64 g SO2含有氧原子数为NA | |
| B. | 物质的量浓度为0.5mol/LAl2(SO4)3溶液,含有SO42-离子数为1.5NA | |
| C. | 标准状况下,22.4 LSO3的分子数为NA | |
| D. | 常温常压下,14 g N2含有分子数为0.5 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com