
铁及其化合物与生产、生活关系密切。
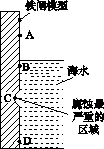
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
①该电化腐蚀称为________。
②图中A、B、C、D四个区域,生成铁锈最多的是________(填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
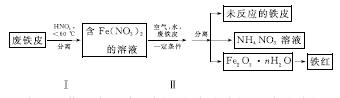
①步骤Ⅰ若温度过高,将导致硝酸分解。硝酸分解的化学方程式为______________________________。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O===2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为____________________________。
③上述生产流程中,能体现“绿色化学”思想的是______(任写一项)。
(3)已知t ℃时,反应FeO(s)+CO(g)Fe(s)+CO2(g)的平衡常数K=0.25。
①t ℃时,反应达到平衡时n(CO)∶n(CO2)=________。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入x mol CO, t ℃时反应达到平衡。此时FeO(s)转化率为50%,则x=________。
(1)①吸氧腐蚀 ②B
(2)①4HNO3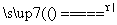 4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
4NO2↑+O2↑+2H2O ②4Fe+10HNO3===4Fe(NO3)2+NH4NO3+3H2O ③氮氧化物排放少(或其他合理答案) (3)①4∶1 ②0.05
[解析] (1)①若为析氢腐蚀则B、C、D的腐蚀程度相同,则该电化学腐蚀为吸氧腐蚀。②氧气的浓度越大,吸氧腐蚀越严重,则B区域产生铁锈最多。(2)①硝酸的受热分解产生NO2、O2、H2O ,则根据氧化还原的化合价升降法配平其化学方程式为4HNO3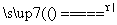 4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
4NO2↑+O2↑+2H2O。②根据图示和信息可知:该生产流程中生成了 NH4NO3,则硝酸与废铁皮反应的化学方程式为 4Fe+10HNO3===4Fe(NO3)2+ NH4NO3+3H2O。
(3)①在t ℃时,K=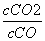 =
=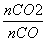 =0.25,则
=0.25,则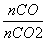 =4。
=4。
② FeO(s)+ CO(g)  Fe(s)+CO2(g)
Fe(s)+CO2(g)
n起始/mol 0.02 x 0 0
n转化/mol 0.01 0.01 0.01 0.01
n平衡/mol 0.01 x-0.01 0.01 0.01
根据t ℃时,K= 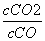 =
= 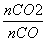 =
=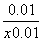 =0.25 ,求得x=0.05。
=0.25 ,求得x=0.05。


 开心试卷期末冲刺100分系列答案
开心试卷期末冲刺100分系列答案 双基同步导航训练系列答案
双基同步导航训练系列答案 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源: 题型:
甲乙两只烧杯中分别盛有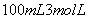 的硫酸和
的硫酸和 溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为
溶液,向两只烧杯中分别加入等质量的铝粉,反应结束后测得生成的气体体积比为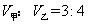 则加入的铝粉的质量为( )
则加入的铝粉的质量为( )
A、
B、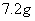
C、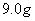
D、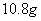
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是( )
A.该溶液中,K+、Fe2+、C6H5OH、Br-可以大量共存
B.和KI溶液反应的离子方程式:
Fe3++2I-===Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO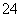 +Ba2++3OH-===Fe(OH)3↓+BaSO4↓
+Ba2++3OH-===Fe(OH)3↓+BaSO4↓
D.1 L 0.1 mol·L-1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第________周期第________族;S的基态原子核外有________个未成对电子;Si的基态原子核外电子排布式为________________________。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si____S | O2-____Na+ | NaCl____Si | H2SO4____HClO4 |
(3)CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 mol CuCl(s),放热44.4 kJ,该反应的热化学方程式是________________________________________________________________________
________________________________________________________________________。
(4)ClO2常用于水的净化,工业上可用Cl2氧化NaClO2溶液制取ClO2。写出该反应的离子方程式,并标出电子转移的方向和数目:________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
重铬酸钾是工业生产和实验室的重要氧化剂。工业上常用铬铁矿(主要成分为FeO·Cr2O3,以及SiO2、Al2O3等杂质)为原料生产。实验室模拟工业法用铬铁矿制K2Cr2O7的主要工艺如下:

图K52
反应器中主要发生的反应为
Ⅰ.FeO·Cr2O3+NaOH+KClO3→Na2CrO4+Fe2O3+H2O+KCl(未配平);
Ⅱ.Na2CO3+SiO2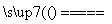 Na2SiO3+CO2↑;
Na2SiO3+CO2↑;
Ⅲ.Al2O3+2NaOH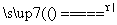 2NaAlO2+H2O。
2NaAlO2+H2O。
在步骤③中将溶液的pH调节到7~8,可以将SiO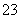 和AlO
和AlO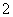 转化为相应的沉淀除去。
转化为相应的沉淀除去。
(1)在反应Ⅰ中氧化剂是________,若有245 g KClO3参加反应,则转移的电子数为______________________。
(2)反应器中生成的Fe2O3又可和Na2CO3反应得到一种摩尔质量为111 g/mol的化合物,该化合物能剧烈水解,在操作②中生成沉淀而除去。写出生成该化合物的化学反应方程式:________________________________。
(3)操作④的目的是将CrO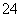 转化为Cr2O
转化为Cr2O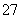 ,其现象为____________________,离子方程式为________________________________________________________________________
,其现象为____________________,离子方程式为________________________________________________________________________
________________________________________________________________________。
(4)请选用合适的方法进一步提纯粗产品重铬酸钾______(填字母)。
A.重结晶 B.萃取分液
C.蒸馏
(5)分析产品中K2Cr2O7的纯度是利用硫酸酸化的K2Cr2O7将KI氧化成I2,然后利用相关物质测出I2的量从而获得K2Cr2O7的量。写出酸化的K2Cr2O7与KI反应的化学方程式:________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于乙醇的说法中正确的是( )
A.乙醇的密度比水小,遇水混合时浮在上层
B.乙醇在水中能电离出少量氢离子
C.乙醇分子中的氢均可被钠置换
D.在一定条件下,镁也可跟乙醇反应放出氢气
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关反应的叙述正确的是
A.铝箔在空气中受热熔化,并不滴落,说明铝与氧气没有发生化学反应
B.NH3+H3O+=NH4++H2O说明结合H+的能力:H2O>NH3
C.FeCl2、Fe(OH)3均可通过化合反应制得
D.分子式为C2H4O2的化合物只能电离,不能水解
查看答案和解析>>
科目:高中化学 来源: 题型:
NA表示阿伏伽德罗常数,下列叙述正确的是( )
A.1 mol FeI2与足量氯气反应时转移的电子数为2NA
B.2 L 0.5 mol·L-1硫酸钾溶液中阴离子所带电荷数为NA
C.1 mol Na2O2固体中含离子总数为4NA
D.丙烯和环丙烷组成的42 g混合气体中氢原子的个数为6NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com