
| A. | 将含少量CO2的CO气体通入盛有足量Na2O2的密闭容器中,并不断用电火花引燃 | |
| B. | 将l mol Mg置于10 L空气(标况)中,使之在高温下反应 | |
| C. | 标准状况下,将11.2L H2S与22.4L O2混合点燃 | |
| D. | 在强光持续照射下,向过量的Ca(ClO)2的悬浊液中通入少量CO2 |
分析 A.电火花不断引燃,CO燃烧生成二氧化碳,二氧化碳能与足量Na2O2反应,最终气体完全反应;
B.Mg与氧气、氮气生成MgO和氮化镁;
C.根据2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O分析;
D.反应生成碳酸钙和HClO,光照下HClO分解,最终二氧化碳完全反应
解答 解:A.电火花不断引燃,CO燃烧生成二氧化碳,二氧化碳能与足量Na2O2反应,最终气体完全反应,相当于CO与Na2O2反应生成碳酸难,CO完全消耗,故A不选;
B.Mg与氧气、氮气生成MgO和氮化镁,将l molMgg置于10 L空气(标况)中,使之在高温下反应,空气过量,Mg完全反应,故B不选;
C.已知2H2S+3O2$\frac{\underline{\;点燃\;}}{\;}$2SO2+2H2O,11.2L H2S最多消耗11.2L×$\frac{3}{2}$=16.8L,氧气过量,不能完全消耗,故C选;
D.反应生成碳酸钙和HClO,光照下HClO分解,最终二氧化碳完全反应,而次氯酸钙过量,不能完全消耗,故D选;
故选CD.
点评 本题考查了元素化合物的性质,侧重化学反应的考查,明确物质的性质及特性即可解答,注意量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 18 g H2O中含有的质子数为8NA | |
| B. | 12 g金刚石中含有的碳原子数为4NA | |
| C. | 46 g NO2和N2O4混合气体中含有原子总数为3NA | |
| D. | 1 mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去2NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | ||||||
| C | D | E | |||||
| F | G | H | I | J | K |

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
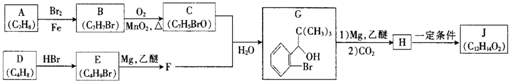
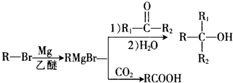
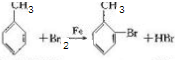 ,其反应类型为取代反应
,其反应类型为取代反应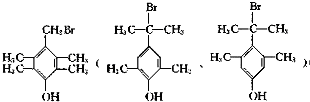 (其中一种)(写出一种即可)
(其中一种)(写出一种即可)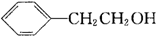 唑I.反应条件1为Br2、光照;反应条件2所选择的试剂为镁、乙醚;L的结构简式为
唑I.反应条件1为Br2、光照;反应条件2所选择的试剂为镁、乙醚;L的结构简式为 .
.查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
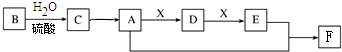
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
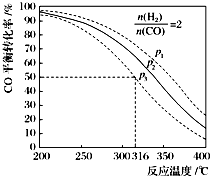 二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:
二甲醚(CH3OCH3)是一种应用前景广阔的清洁燃料,以CO和H2为原料生产二甲醚主要发生以下三个反应:| 编号 | 热化学方程式 | 化学平衡常数 |
| ① | CO(g)+2H2(g)?CH3OH(g)△H1 | K1 |
| ② | 2CH3OH(g)?CH3OCH3(g)+H2O(g)△H2=-24kJ•mol-1 | K2 |
| ③ | CO(g)+H2O(g)?CO2(g)+H2(g)△H3=-41kJ•mol-1 | K3 |
| 化学键 | H-H | C-O | C=O | H-O | C-H |
| E/(kJ.mol-1) | 436 | 343 | 1076 | 465 | 413 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时负极得电子,质量减轻 | |
| B. | 放电时电解质溶液中的OH-向正极移动 | |
| C. | 充电时阴极附近溶液的pH减小 | |
| D. | 充电时阳极反应:Ni(OH)2-e-+OH-═NiOOH+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com