
科目:高中化学 来源: 题型:
X、Y、Z、W为四种短周期主族元素,其中X、Z同族,Y、Z同周期,W是短周期主族元素中原子
半径最大的,X原子最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价代数和为6。下
列说法正确的是( )
A.Y和Z的氧化物的水化物酸性Y大于Z的,所以非金属性Y大于Z
B.原子半径由小到大的顺序为:X< Z < Y
C.Y、Z两种元素气态氢化物中,Z的气态氢化物更稳定
D.X与W形成的两种化合物中,阴、阳离子物质的量之比均为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各式中,属于正确的电离方程式的是
A.HCO3- + H2O  H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
H2CO3 + OH- B.HCO3- +OH- === H2O + CO32-
C.NH3 + H+ === NH4+ D.NH3·H2O  NH4+ + OH-
NH4+ + OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.无色溶液中:K+、Na+、Cu2+、SO42-
B.水电离产生的c(H+)=10-13 mol·L-1的溶液中:Na+、Cl-、NO3-、SO42-
C.0.1 mol·L-1FeSO4溶液中:K+、NH4+、MnO4-、ClO-
D.c(OH-)=10-13 mol·L-1的溶液中:Al3+、NO3-、I-、Cl-
查看答案和解析>>
科目:高中化学 来源: 题型:
根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,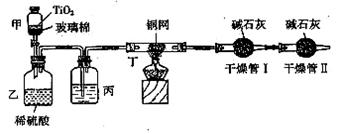 先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用下图装置进行实验,测定
CN-被处理的百分率。
现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液共200 mL(其中CN-的浓度为0.2 mol/L)倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:
甲中的反应:
乙中的反应:
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。
丙装置中的试剂是 ,丁装置的目的是 ;干燥管Ⅱ的作用是 。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比
__________(填“偏高”或“偏低”),简述可能的原因: 。
(4)若干燥管Ⅰ中碱石灰增重1.408 g,则该实验中测得CN-被处理的百分率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
对于Zn(s)+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH <0 的化学反应下列叙述不正确的是
A.该反应是放热反应 B.ΔH的值与反应方程式的计量系数有关
C.若将该反应设计成原电池则锌为负极
D.若将其设计为原电池,当有32.5g锌溶解时,正极放出气体一定为11.2L
查看答案和解析>>
科目:高中化学 来源: 题型:
如下图所示,△H1=-393.5 kJ•mol-1,△H2=-395.4 kJ•mol-1,下列说法或表示式正确的是
A.C(s石墨)= C(s金刚石)△H= +1.9 kJ•mol-1
B.金刚石的稳定性大于石墨
C.石墨和金刚石转化是物理变化
D.1 mol石墨本身具有的总能量比1 mol金刚石本身具有的总能量大1.9 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物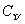 H3
H3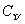 H===CH—
H===CH—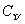 ≡CH中标有“·”的碳原子的杂化方式依次为 ( )
≡CH中标有“·”的碳原子的杂化方式依次为 ( )
A.sp、sp2、sp3 B.sp2、sp、sp3 C.sp3、sp2、sp D.sp3、sp、sp2
查看答案和解析>>
科目:高中化学 来源: 题型:
为了测定某铜银合金的成分,将30.0g合金溶于80mL13.5mol/L的浓硝酸中,
待合金完全溶解后,收集到6.72L(标准状况)NO和NO2的混合气体,并测得溶液中H+浓度为1mol/L。
假设反应后溶液的体积仍为80mL,试计算.
(1)被还原硝酸的物质的量。
(2)合金中银的质量分数。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com