
【题目】将CO2转化为甲醇的原理为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
CH3OH(g)+H2O(g) ΔH <0。500 ℃时,在体积为1 L 的固定容积的密闭容器中充入1mol CO2、3mol H2,测得CO2浓度与CH3OH 浓度随时间的变化如图所示,从中得出的结论错误的是( )
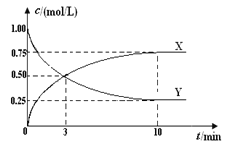
A.曲线X可以表示CH3OH(g)或H2O(g)的浓度变化
B.从反应开始到10min时,H2的反应速率υ(H2)=0.225 mol/(L·min)
C.平衡时H2 的转化率为75%
D.500 ℃时该反应的平衡常数K=3
【答案】D
【解析】
试题分析:A、曲线x随反应进行浓度逐渐增大,表示生成物的浓度变化。曲线Y随反应进行浓度减小,表示反应物的浓度变化。反应进行到3min时X增加了0.5mol/L,而Y减少了1.0mol/L-0.5mol/L=0.5mol/L,这说明X、Y的浓度变化量之比为1:1,因此根据反应的化学方程式可知曲线x可以表示CH3OH浓度变化,曲线Y可以表示CO2浓度变化,A正确;B、根据以上分析可知X可以表示甲醇,则10min内用甲醇表示的反应速率为=0.75molL÷10min=0.075mol/(Lmin)。反应速率之比等于化学计量数之比,用氢气表示的反应速率=3×0.075mol/(Lmin)=0.225mol/(Lmin),B正确;C、根据以上分析可知X可以表示甲醇,平衡时甲醇的浓度变化量=0.75mol/L,则根据方程式可知氢气的浓度变化量=3×0.75mol/L=2.25mol/L,则参加反应的氢气的物质的量=1L×2.25mol/L=2.25mol,所以氢气的转化率=![]() ×100%=75%,C正确;D、根据以上分析可知X可以表示甲醇,其浓度变化量=0.75mol/L,则:
×100%=75%,C正确;D、根据以上分析可知X可以表示甲醇,其浓度变化量=0.75mol/L,则:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始浓度(mol/L) 1 3 0 0
转化浓度(mol/L) 0.75 2.25 0.75 0.75
平衡浓度(mol/L) 0.25 0.75 0.75 0.75
因此根据化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值可知,该反应的平衡常数=![]() =5.3,D错误,答案选D。
=5.3,D错误,答案选D。


 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. 与K+最近且距离相等的K+有6个
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【加试题】I.无机物A是一种固体,熔点178℃,30℃以下为浅黄色。经测定A(相对分子质量为184)含两种元素,原子个数比为1:1。隔绝空气迅速加热A将发生爆炸,爆炸后残留物B呈淡黄色。该淡黄色物质在空气中加热会燃烧并产生刺激性气味。在一定条件下,6.18g液体SCl2和2.72g气体C恰好完全反应生成A和单质B及6.42g离子化合物D,D的水溶液的pH<7。已知气体C在标准状况下的密度为0.76g·L-1。
(1)A的化学式 ,C的电子式 。
(2)写出SCl2和气体C反应的化学方程式 。
Ⅱ.雾霾已经成为社会各界共同关注的热门话题,其中汽车尾气和燃煤尾气是造成空气污染的原因之一。
(1)汽车尾气净化的主要原理为:2NO(g)+2CO(g) ![]() 2CO2(g)+N2(g)
2CO2(g)+N2(g)
①该反应在低温下能自发进行,该反应的△H 0。(选填“>”、“<”)
②在某一绝热、恒容的密闭容器中充入一定量的NO、CO发生上述反应,测得正反应的速率随时间变化的曲线如右图所示(已知:t2-tl = t3-t2)。则下列说法不正确的是 。(填编号)

A.反应在c点未达到平衡状态
B.反应速率a点小于b点
C.反应物浓度a点大于b点
D.NO的转化率:tl~t2>t2~t3
(2)煤的综合利用有利于减少环境污染。合成氨工业原料气的来源之一水煤气法,在催化剂存在条件下有下列反应:
C(s)+H2O(g)![]() CO(g)+H2(g) △H1
CO(g)+H2(g) △H1
H2O(g)+CO(g)![]() CO2(g)+H2(g) △H2
CO2(g)+H2(g) △H2
C(s)+2H2O(g)![]() CO2(g)+2H2(g) △H3
CO2(g)+2H2(g) △H3

①△H3和△H1、△H2的关系为△H3= 。
②在恒温条件下,将l mol CO和1 mol H2O(g)充入某固定容积的反应容器,达到平衡时有50%的CO转化为CO2。在tl时保持温度不变,再充入1 mol H2O(g),请在右图中画出tl时刻后H2的体积分数变化趋势曲线。(t2时刻重新达到平衡)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修3:物质结构与性质】
已知X、Y、Z、R、Q为周期表中原子序数依次增大的前36号元素。相关信息如下:
X元素是宇宙中最丰富的元素 |
Y元素基态原子的核外p电子数比s电子数少1 |
Z元素被誉为“太空金属”,也有“生物金属”之称,其基态原子次外层有2个未成对电子 |
R元素在元素周期表的第十一列 |
Q元素在周期表里与R元素在同一个分区 |
请回答下列问题:
(1)YX3中心原子的杂化轨道类型是 ,离子化合物YX5的电子式是 。
(2)CO与Y2属于等电子体,1 个CO分子中含有的π键数目是 个。
(3)工业上利用ZO2和碳酸钡在熔融状态下制取化合物A(A可看做
一种含氧酸盐)。A晶体的晶胞为正方体(如右图)。

①制备A的化学反应方程式是 ;
②在A晶体中,Z的配位数为 ;
③在A晶体中,若将Z元素置于立方体的体心,Ba元素置于立方体的顶点,则O元素处于立方体的 。
(4)R2+离子的外围电子层电子排布式为 。R2O的熔点比R2S的 (填“高”或“低”)。
(5)Q元素和硫(S)元素能够形成化合物B。B晶体的晶胞为正方体(如右图),若晶胞棱长为540.0 pm,则晶胞密度为 g·cm—3(列式并计算)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——物质结构与性质】
氮及其化合物与人类生产、生活息息相关。回答下列问题:
(1)基态N原子中电子在2p轨道上的排布遵循的原则是________。前4周期元素中,基态原子核外电子排布成单电子数最多的元素的价层电子排布式为__________________。
(2)C、N、O三种元素第一电离能从大到小的顺序是__________________________
(3)N2F2分子中N原子的杂化方式是___________________,l mol N2F2含有______mol![]() 键。
键。
(4)NF3的键角______NH3的键角(填“<”“>”或“=”),原因是__________________。
(5)NH4BF4(氟硼酸铵)是合成氮化硼纳米管的原料之一。l mol NH4BF4_________mol配位键。
(6)安全气囊的设计原理为6NaN3+FeIO3![]() Na2O+2Fe+9N2↑
Na2O+2Fe+9N2↑

①等电子体的原理是:原子总数相同,价电子总数相同的分子或离子具有相似的化学键特征,具有许多相近的性质。写出两种与N3-互为等电子体的分子或离子____________。
②Na2O的晶胞结构如图所示,品胞边长为566pm,晶胞中氧原子的配位数为_____,Na2O晶体的密度为_____g·cm-3(只要求列算式,不必计算出结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】马尔柯夫尼柯夫因为提出碳碳双键的加成规则而闻名于世,该规则是指不对称的烯烃与HX或HCN加成时,氢总是加到含氢较多的双键碳原子上。
已知:①CH3CH2CN![]() CH3CH2COOH
CH3CH2COOH
②F的结构简式:
以下是该有机物F的合成路线,请填写下列空白。

(1)写出下列物质的结构简式A ,C 。
(2)反应①的反应类型是 ,反应②的反应类型是 。
(3)写出与D互为同分异构体,结构中含有苯环且苯环上含有一个乙基(苯环上的取代基处于对位)的酯类的结构简式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙醇和乙酸是生活中两种常见的有机物。请回答下列问题:
(1)乙醇的结构简式为CH3CH2OH,乙醇分子含有的官能团为 ;
(2)生活中常用食醋除去暖瓶内的水垢(主要成分是CaCO3),反应的化学方程式为2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O。通过这个事实,你得出醋酸与碳酸的酸性强弱关系是:醋酸 碳酸(填“>”或“<”);
(3)在浓硫酸的催化作用下,加热乙酸和乙醇的混合溶液,可发生酯化反应。请完成化学方程式:CH3COOH + CH3CH2OH![]() CH3COOCH2CH3+ 。
CH3COOCH2CH3+ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】观察下面的元素周期表,并回答下列问题

(1)在上面元素周期表中,全部是金属元素的区域为 。
甲 乙 丙 丁
(2)用实线画出金属与非金属的分界线。(在答题卷图上完成)
(3)请问:仅用①②④三种元素 (填“能”或“不能”)形成离子化合物;若能,请写出该物质的名称_________(若不能,此格不填)
若用球棍模型表示①和③形成的化合物的分子结构,应该是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学——选修3:物质结构与性质]
X、Y、Z、W、Q为前四周期的五种元素,且原子序数依次增大。已知X、Y、Z、W均为非金属元素,XW2分子与Y3-为等电子体,元素W和元素Z为同族元素,Q的最外层电子数为2,次外层电子数等于Y和W2 -最外层电子数之和,根据以上信息回答下列问题:
(1)上述五种元素中电负性最大的是___(填元素符号,下同),Y的第一电离能大于Z的第一电离能原因___________________________________。
(2)XW2的电子式为______________。
(3)Q的价电子排布式为_____________,Y3-的分子构型为______________。
(4)下列关于WZ2结构的说法正确的是___________(填序号)。
a.WZ2为直线形非极性分子 b.WZ2为直线形极性分子
c.WZ2中W为sp3杂化 d.WZ2中W为sp2杂化
(5) W有两种常见的含氧酸,较高价的酸性比较低价的______,理由______________。
(6)α-QW的晶胞是立方体,用X射线衍射法测得该晶体晶胞边长=520.0pm,26℃测得该晶体的密度为4.1g/cm3,请列式计算一个晶胞中含有的Q、W离子数。(5.23≈140.6)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com