
【题目】不能使酸性KMnO4溶液褪色的是( )
A.乙烯
B.聚乙烯
C.丙烯
D.乙炔
 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】I.锰是在地壳中广泛分布的元素之一,其单质和化合物在工农业生产中有着重要的作用。已知Al的燃烧热为ΔH=—ckJ·mol—1,金属锰可用铝热法制得。其余相关热化学方程式为:3Mn3O4(s)+8Al(s)=9Mn(s)+4Al2O3(s) ΔH1 = akJ·mol—1
3MnO2(s)=Mn3O4(s)+O2(g) ΔH2 = b kJ·mol—1
则3MnO2(s)+4Al(s)=3Mn(s)+2Al2O3(s) ΔH3 =__________kJ·mol—1(用含a、b、c的式子表示)
II.无机和有机氰化物在工农业生产中应用广泛,尤其是冶金工业常用氰化物,含氰废水的处理显得尤为重要。含氰废水中的氰化物常以[Fe(CN)6]3-和CN-的形式存在,工业上有多种废水处理方法。
(1)电解处理法:用如图所示装置处理含CN-废水时,控制溶液pH为9~10并加入NaCl,一定条件下电解,阳极产生的ClO-将CN-氧化为无害物质而除去。铁电极为__________(填“阴极”或“阳极”),阳极产生ClO-的电极反应为__________,阳极产生的ClO-将CN-氧化为无害物质而除去的离子方程式为__________。
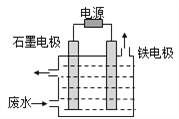
(2)UV(紫外光线的简称)—H2O2氧化法。
实验过程:取一定量含氰废水,调节pH,加入一定物质的量的H2O2,置于UV工艺装置中,光照一定时间后取样分析。
【查阅资料】
①在强碱性溶液中4[Fe(CN)6]3-+4OH—=4[Fe(CN)6]4-+O2↑+2H2O,[Fe(CN)6]4-更稳定;
②[Fe(CN)6]3-转化为CN-容易被H2O2除去;
③HCN是有毒的弱酸,易挥发。
①废水中的CN一经以下反应实现转化:CN—+H2O2+H2O=A+NH3↑,则A是__________(用符号表示)。
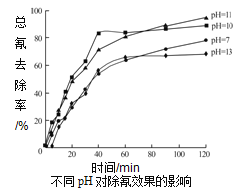
②含氰废水在不同pH下的除氰效果如图所示,pH选择的最佳范围应为__________(a.7-10;b.10-11;c.11-13),解释该pH不宜太大的原因__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于乙烯说法正确的是
A. 乙烯使酸性高锰酸钾溶液及溴的四氯化碳溶液褪色原理相同
B. 工业利用乙烯水化法制乙醇,是发生了取代反应
C. 水果运输中为延长果实的成熟期,常在车厢里放置浸泡过高锰酸钾溶液的硅藻土
D. 乙烯在空气中燃烧,发生火焰明亮并带有浓烟的火焰
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在三个体积均为0.5 L的恒容密闭容器中发生反应:
CO(g)+Cl2(g)![]() COCl2(g)
COCl2(g)
其中容器Ⅰ中5 min时到达平衡。
容器编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol | ||
CO | Cl2 | COCl2 | COCl2 | ||
Ⅰ | 500 | 1.0 | 1.0 | 0 | 0.8 |
Ⅱ | 500 | 1.0 | a | 0 | 0.5 |
Ⅲ | 600 | 0.5 | 0.5 | 0.5 | 0.7 |
下列说法正确的是
A. 容器Ⅰ中前5 min的平均反应速率v(CO)=0.16 mol·L-1·min-1
B. 该反应的正反应为吸热反应
C. 容器Ⅱ中起始时Cl2的物质的量为0.55 mol
D. 若起始时向容器Ⅰ中加入CO 0.8 mol、Cl2 0.8 mol,达到平衡时CO的转化率大于80%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于药品的使用和作用下列说法正确的是
A.R表示非处方药,OTC表示处方药
B.麻黄碱是国际奥委会严格禁止使用的兴奋剂
C.毒品就是有毒的药品
D.我国明代医学家李时珍所著的医学名著是《神农本草经》
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在日常生活中出现了“加碘食盐”“增铁酱油”“高钙牛奶”“富硒茶叶”“含氟牙膏”等名词,这里的碘、铁、钙、硒、氟应理解为
A. 元素 B. 单质 C. 分子 D. 氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F是短周期元素,周期表中A与B、B与C相邻;C与E同主族;A与C最外层电子数之比为2:3,B的最外层电子数比C的最外层电子数少1个; F元素的原子在周期表中半径最小;常见化合物D2C2与水反应生成C的单质,且溶液使酚酞溶液变红。
(1)F的三种核素表示符号为______,E的名称为______,D的最高价氧化物的水化物的电子式:______。
(2)在B、C、D、E、F原子形成的单核离子中离子半径最小的是____,离子半径最大的是____。(填离子符号)
(3)A、B、C的氢化物稳定性顺序为_____(用分子式表示);B的氢化物和B的最高价氧化物的水化物反应生成Z,反应中断裂化学键是_____,形成的化学键是________。(填“离子键”、“极性键”、“非极性键”、“氢键”)
(4)F2C和F2E中,沸点较高的是__________(填化学式),其主要原因是_________。
(5)两种均含C、D、E、F四种元素的化合物相互反应放出气体的反应离子方程式为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com